
| A、1mol Cl2与足量Fe反应转移电子数一定为3NA |
| B、标准状况下,22.4L NH3中含有共价键的数目为NA |
| C、1.0L 1mol?L-1的硅酸钠水溶液中含有的氧原子数为3NA |
| D、4.6g Na完全转化成氧化钠和过氧化钠的混合物,混合物中阴离子总数为0.1NA |
| V |
| Vm |
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
| 4.6g |
| 23g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na+、Ba2+、Cl-、SO32- |
| B、Na+、Ba2+、AlO2-、NO3- |
| C、NH4+、K+、Cl-、NO3- |
| D、Na+、K+、NO3-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
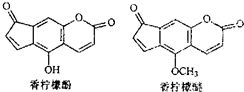
| A、香柠檬醚的分子式为C13H6O4 |
| B、1mol香柠檬酚最多可与2mol Br2发生反应 |
| C、香柠檬酚通过取代反应可转化成香柠檬醚 |
| D、1mol香柠檬酚在NaOH溶液中,最多能消耗2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体均为无色透明的液体 |
| B、不能跟酸反应的氧化物一定能跟碱反应 |
| C、石油分馏、干冰升华、煤的干馏都只涉及物理变化 |
| D、向沸水中逐滴加入少量FeCl3饱和溶液,可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaOH溶液区分乙醇和乙醛 |
| B、可用饱和Na2CO3溶液除去CO2中的SO2 |
| C、实验室用浓硫酸干燥Cl2或H2 |
| D、仅用新制Cu(OH)2检验淀粉水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com