
| A. | NH4+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
分析 铵盐易和强碱反应,氢氧化钠溶液和氯化铵溶液反应生成一水合氨和氯化钠,一水合氨微热一水合氨分解生成氨气和水,氯化铝和过量氢氧化钠溶液反应生成偏铝酸钠溶液,再加入过量盐酸生成氯化铝,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,生成亚铁离子具有还原性,易被氧化为三价铁,据此分析判断.
解答 解:铵盐易和强碱反应,氢氧化钠溶液和氯化铵溶液反应生成一水合氨和氯化钠,氢氧根离子与NH4+结合微热会产生挥发性的氨气,所以铵根减少,铝离子加过量过氧化钠时生成偏铝酸钠,再加过量盐酸又反应生成铝离子,即Al3+数目基本不变,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁微热会被空气中氧气氧化为氢氧化铁,加入过量盐酸溶解后得到氯化铁溶液,亚铁离子减少,铁离子增多,故选B.
点评 本题主要考查物质的性质,要求要求学生熟记教材知识,灵活应用,主要是离子性质的熟练掌握,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1mol•L-1Na2SO4溶液中Na+个数为2 NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 乙烯是石油裂解后的产物 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
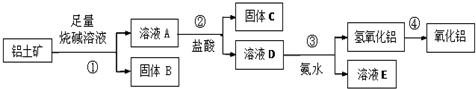
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com