
【题目】“乙醇催化氧化”的实验装置如图所示:
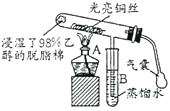
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
【答案】参与了 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 放热 乙醇、乙醛
2CH3CHO+2H2O 放热 乙醇、乙醛
【解析】
(1)加热时Cu丝与O2反应产生CuO,然后伸入乙醇中,铜丝表面由黑色变为红色,说明在过程中反复发生Cu-CuO的变化过程,证明催化剂Cu参加了化学反应;乙醇被催化氧化产生乙醛和水;
(2)反应发生后,熄灭酒精灯,反应可继续发生,证明反应放出的热量足以使后面的物质继续进行反应;
(3)乙醇被氧化产生的乙醛为液体,同时乙醇容易挥发,会与乙醛一同进入试管B中。
(1)不断鼓入空气,在加热时红热Cu丝与O2反应产生黑色的CuO,CuO与乙醇蒸气接触,铜丝表面又由黑色变为红色,说明CuO变为红色的Cu单质,这说明在乙醇氧化 的过程中发生Cu-CuO-Cu的变化过程,也就证明催化剂Cu参加了化学反应;乙醇被催化氧化产生乙醛,同时有水生成,反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(2)在不断鼓入空气的情况下反应发生后,熄灭酒精灯,反应仍可继续发生,证明乙醇的催化氧化反应是放热反应,反应放出的热量足以使后面的物质继续发生氧化反应;
(3)乙醇被催化氧化产生了乙醛,乙醛为液体易溶于水,同时由于乙醇的沸点比较低,也容易挥发,因此会与反应产物乙醛一同进入试管B的蒸馏水中。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列图示的实验设计能实现相应实验目的的是
A. 
验证FeCl3溶液中是否含有Fe2+
B. 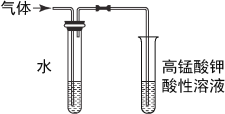
检验溴乙烷消去的产物
C. 
检验氯气与亚硫酸钠是否发生反应
D. 
对比Fe3+和Cu2+对H2O2分解的催化效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如图所示:
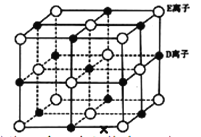
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为__________。它有______种同分异构体。若该烃与![]() 发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
(2)若该有机物分子中只有一个氧原子,其分子式为_____________________。
(3)若该有机物![]() 完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期第ⅡA、ⅢA族金属元素的原子失去电子后,生成的阳离子的电子层结构( )。
A.与它同周期稀有气体元素原子的电子层结构相同
B.与它上一周期稀有气体元素原子的电子层结构相同
C.与它下一周期稀有气体元素原子的电子层结构相同
D.以上说法都不全面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B. 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D. 由置换反应I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一些晶体的结构示意图。
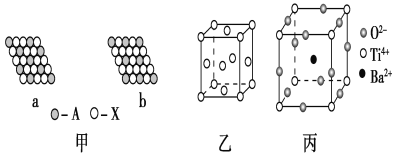
(1)下列关于晶体的说法正确的是________(填字母)。
A.晶体的形成与晶体的自范性有关
B.可以用X射线衍射仪区分晶体和非晶体
C.石蜡是非晶体,但有固定的熔点
D.晶胞就是晶体
(2)图甲表示的是晶体的二维平面示意图,a、b中可表示化学式为AX3的化合物的是________。(填“a”或“b”)
(3)图乙表示的是金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________,铜原子的配位数为________。
②该晶胞称为________(填字母)。
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
(4)图丙为钛酸钡晶体的晶胞结构,该晶体经X射线分析得出,重复单位为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
①写出该晶体的化学式:_____________________________。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的________位置。
③Ti4+的氧配位数和Ba2+的氧配位数分别为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com