
| ���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������/% | |
| Fe | O | ||
| �ƾ��� | Fe��O | 74.50 | 25.50 |
| �����־ƾ��� | Fe��O | 76.48 | 23.52 |
| �ƾ���� | Fe | 100.00 | 0.00 |
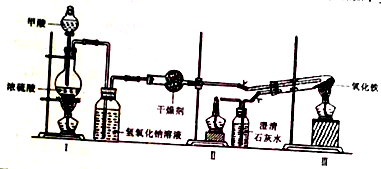
���� ��1������װ��ͼ��֪�Ʊ�һ����̼��ԭ��Ϊ������Ũ������������·ֽ⣬HCOOH�ֽ�����CO��ˮ��
��2��CO��������ϼ����ױ�ը�����Ե�ȼǰҪ���鴿�ȣ�����һ����̼�Ŀ�ȼ�ԺͶ��������з�����ȼ���Ⱥ�
��3�����¶Ƚϸ�ʱ��������������Ӧ�������ͨ��һ����̼�������������
��4��Fe��FeO��Fe2O3��Fe3O4��FeԪ�صİٷֺ����ֱ�Ϊ100%��77.8%��70%��72.4%����ϱ��е������ж����ʵ���ɣ�
��5�����ݾƾ��Ƽ��ȵõ��IJ���ΪFe3O4��Fe������Ԫ�صİٷֺ���Ϊ74.50%����Fe3O4������Ϊx��Fe������Ϊy���������������������㣻
��6���ƾ��ƵĻ���ƽ��600�ȣ������ܴﵽ���ȶ����ڵ��¶ȣ����ǣ���ʵ�ʲ��������У��������ȼ�ɢ�ȵ����⣬����־ֲ��¶Ƚϸߵ���������Fe�Ĺ����з����ķ�Ӧ��һ����̼������������������������һ����̼��������������Ӧ��������һ����̼�����������������ݴ���д����ʽ��
��� �⣺��1����Ũ������������£�HCOOH�ֽ�ɵ�CO�����������غ��֪��һ������Ϊˮ����Ӧ�Ļ�ѧ����ʽΪ��HCOOH $��_{��}^{Ũ����}$CO��+H2O��
�ʴ�Ϊ����Һ©����HCOOH $��_{��}^{Ũ����}$CO��+H2O��
��2��CO��������ϼ����ױ�ը�����Ե�ȼǰҪ���鴿�ȣ���ʵ�鲽���ij�������ָ����CO���ȣ�Ϊ���ž�װ���ڵĿ����������ȼ�ƾ��Ʒ�����ը������Ҫ��ͨ��һ����̼���壬��һ����̼�ж�������ֱ���ŷŵ������У�Ӧ�����ȼ����������ʵ�鲽��ۺ�Ҫ�ȵ�ȼII���ľƾ��ƣ�
�ʴ�Ϊ������CO���ȣ�II��
��3��Ϊ��ֹ�������Ļ�ԭ�ɲ������¶Ƚϸ�ʱ������е�������Ӧ��ʵ�鲽��ݲ�����ȴ������ʱӦע�����ͨ��һ����̼�����������
�ʴ�Ϊ������ͨ��CO���������������
��4��Fe��FeO��Fe2O3��Fe3O4��FeԪ�صİٷֺ����ֱ�Ϊ100%��77.8%��70%��72.4%���ƾ��Ƽ������ò�����FeԪ�صİٷֺ���Ϊ74.50%���������������һ��FeԪ�غ�������74.50%��������һ��FeԪ�غ���С��74.50%���ʻ������һ����Fe��FeO�е�����һ�֣�Ҳһ����Fe2O3��Fe3O4�е�һ�֣�
�������ʻ�ϵ���Fe��Fe2O3��Fe��Fe3O4��FeO��Fe2O3��FeO��Fe3O4 ��4����ϣ�
�������ʻ�ϵ���Fe��Fe2O3��Fe3O4��FeO��Fe2O3��Fe3O4��Fe2O3��Fe��FeO��Fe3O4��Fe��FeO��4����ϣ�
�������ʻ�ϵ���Fe��FeO��Fe2O3��e3O4ֻ��1�֣���9����ϣ�
�ʴ�Ϊ��9��
��5�����ݾƾ��Ƽ��ȵõ��IJ���ΪFe3O4��Fe������Ԫ�صİٷֺ���Ϊ74.50%����Fe3O4������Ϊx��Fe������Ϊy����$\frac{x��\frac{168}{232}+y}{x+y}$��100%=74.50%��
��ã�$\frac{x}{y}$=12��1��
�ʴ�Ϊ��12��
��6������Ӧ�¶ȸ���710�棬Fe���ȶ����ڣ��ƾ��ƵĻ���ƽ��600�ȣ������ܴﵽ���ȶ����ڵ��¶ȣ����ǣ���ʵ�ʲ��������У��������ȼ�ɢ�ȵ����⣬��ʱ�伯�м��Ȼ���־ֲ��¶Ƚϸߵ����ﵽ��ԭ����������Ҫ���¶ȣ��ڼ��ȵ������£�����Fe�Ĺ����з�����3Fe2O3+CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe3O4+CO2��Fe3O4+CO$\frac{\underline{\;\;��\;\;}}{\;}$3FeO+CO2��Fe2O3+3CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2��
�ʴ�Ϊ����ʱ�伯�м���ʹ�ֲ��¶ȴﵽ��ԭ����������Ҫ���¶ȣ�3Fe2O3+CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe3O4+CO2��Fe3O4+CO$\frac{\underline{\;\;��\;\;}}{\;}$3FeO+CO2��Fe2O3+3CO$\frac{\underline{\;\;��\;\;}}{\;}$2Fe+3CO2��
���� ���⿼�����ʵ��Ʊ�ʵ�顢ʵ�鷽����ơ����ʺ����IJⶨ�ȣ���Ŀ�Ѷ��еȣ���ȷʵ��ԭ���ǽⱾ��ؼ����������ʵ����ʷ������ע��Ԫ�ػ�����֪ʶ�Ļ��ۺ�������ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ�ú����Ȼ��Ƶ���ѩ������������ĸ�ʴ | |
| B�� | ���ڳ����ڱ�����������һ�ַ�ɢϵ��������̼���ֵ�ԭ������������ | |
| C�� | �����������°��������ȳ������������������������Ա����������� | |
| D�� | �ҹ����ֳ������ƹ�ʹ�õġ��״����͡��н����ŷŷ������ŵ㣬���κθ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Ȼ�̼��Һ | B�� | ��������Һ�巴Ӧ | ||
| C�� | ��ȼ | D�� | ��һ���������������ӳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
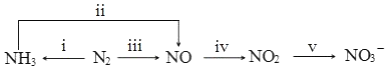
 ��
��
�鿴�𰸺ͽ���>>
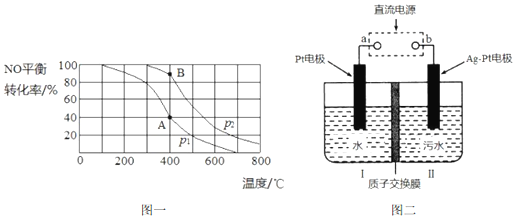
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
�鿴�𰸺ͽ���>>
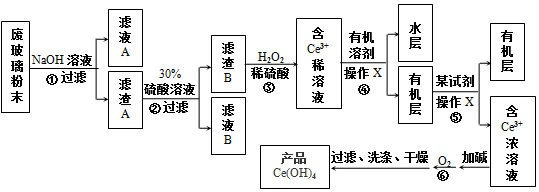
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
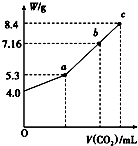 ��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ü��������ˮ�����˵ķ�����ȥNaCl��Һ�л��е�AlCl3 | |
| B�� | ��ȥNaCl��Һ��������Na2S������AgCl���ٹ��� | |
| C�� | ��MgCl2��Һ�м���CaCO3��ĩ����ֽ������˿ɳ�ȥ����FeCl3 | |
| D�� | ��ȥFeCl3��Һ��������CuCl2�������������ۣ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ҫ����NaClO���������Ϊ144.0 g | |
| B�� | ��ͼ��ʾ�������У��������Dz���Ҫ�ģ������һ�ֲ�������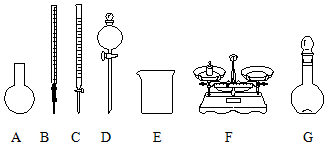 | |
| C�� | ���Ƶ���Һ�ڿ����й��գ����ú���Һ��NaClO�����ʵ���Ũ�ȼ�С | |
| D�� | ����ƿ������ˮϴ����Ӧ��ɲ���������Һ���ƣ�������ƫ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com