
A.a中大
B.b中大?
C.a、b中一样大
D.不一定?
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
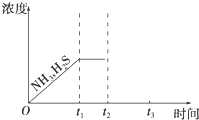 脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.查看答案和解析>>
科目:高中化学 来源:河北省正定中学2011届高三上学期第四次月考化学试题 题型:013
|
已知可逆反应2NO2(g) ①减小容器体积 ②升高温度 ③定容下充入NO2气体 ④定压下充入NO2气体 | |
| [ ] | |
A. |
①②③④ |
B. |
①②③ |
C. |
①② |
D. |
①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若在相同温度下,分别在
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5 mol 氩气,则N2的转化率会起什么变化?正反应速率与原平衡相比,有无变化,简答理由。
(3)若在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com