
分析 (1)从草木灰中提取碳酸钾,可先溶解、过滤除去杂质,然后蒸发、浓缩结晶;
(2)鉴定提取的晶体是碳酸钾,可分别鉴定K+和CO32-.
解答 解:(1)草木灰中除K2CO3外,还有许多其他不溶性杂质.故其操作过程一般是溶解、过滤、蒸发、浓缩结晶等.这些操作中都需用到玻璃棒,如溶解时搅拌,过滤时引流,蒸发时搅拌,结晶后转移晶体,故答案为:BADC;玻璃棒;
(2)要鉴定K2CO3,必定要分别鉴定K+和CO32-,可用焰色反应鉴定K+(K+的焰色透过蓝色钴玻璃观察时显紫色).将晶体溶于稀盐酸,再将生成的无色、无刺激性气味的气体通入澄清石灰水中,石灰水变浑浊,证明含CO32-,
故答案为:用焰色反应鉴定K+(K+的焰色透过蓝色钴玻璃观察时显紫色).将晶体溶于稀盐酸,再将生成的无色、无刺激性气味的气体通入澄清石灰水中,石灰水变浑浊,证明含CO32-.
点评 本题考查物质的分离、提纯实验,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的基本操作方法,难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融) $\frac{\underline{\;电解\;}}{\;}$ Mg+Cl2↑ | B. | Al2O3+3C $\frac{\underline{\;2125℃\;}}{\;}$2Al+3CO↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | HgS+O2$\frac{\underline{\;焙烧\;}}{\;}$ Hg+SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
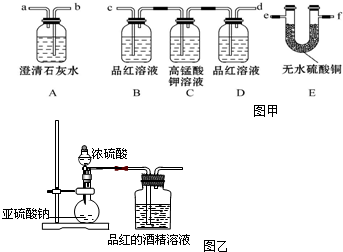
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
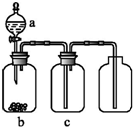 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )| 气体 | a | b | c | |
| A | CO2 | 稀盐酸 | CaCO3固体 | 浓硫酸 |
| B | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| C | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCH4和CH3Cl的混合物所含有的分子数目为NA | |
| B. | 1mol过氧化氢分子中共用电子对数为3NA | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 | |
| D. | 0.1mol Na2CO3•10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | K闭合时,c电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.4mol电子时,I中消耗的H2SO4为0.2 mol | |
| C. | K闭合时,II中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,II可单独作为电源,d电极为正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com