
| A����������ƽ��ȡ1��06 g ��ˮ̼���ƣ����ձ��м�����ˮ�ܽ⣬����ȴ�����º���Һת�Ƶ�����ƿ�� |
| B����ʹ������ƿǰ����������ƿ�Ƿ�����Լ�ƿ�����Ƿ�©ˮ |
| C������ʱ������ˮ�����̶��ߣ����ý�ͷ�ι�С���������ಿ�� |
| D������ʱ�������ӣ���������Һ��Ũ�Ƚ�ƫ�� |
 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����״���£�11.2 L�Ҵ��к��е�̼�����Ϊ2.5NA |
| B�����³�ѹ�£�28 g C2H4��CO�Ļ�������к���̼ԭ�ӵ���ĿΪ1.5NA |
| C�������£�20 L pH��12��Na2CO3��Һ�к��е�OH��������Ϊ0.2NA |
| D����״���£�2.24 L Cl2��������NaOH��Һ��Ӧ��ת�Ƶĵ�����ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
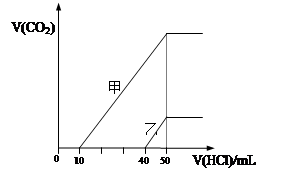
| A��ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol��L-1 |
| B����0<V(HCl)<10mLʱ������Һ�з�����Ӧ�����ӷ���ʽΪ�� OH-+H��=H2O |
| C������Һ�к��е�������NaOH��NaHCO3 |
| D������Һ�еμ���������CO2��������ֵΪ112mL(��״��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����³�ѹ�£�200 g 8��5����H2O2ˮ��Һ�к���ԭ������ΪnA |
| B����״���£�22��4LCHCI3�к�C -H����ĿΪnA |
| C�������£�14g��ϩ��CH3CH=CH2���к�̼ԭ����ΪnA |
| D��������,pH=13������������Һ�У���OHһ��ĿΪnA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��12.5mL 16mol��L-1Ũ����������п��Ӧ��ת�Ƶ�����Ϊ0.2NA |
| B��0.1 mol24Mg18O������������������Ϊ2.0 NA |
| C��1L 1 mol��L��1�Ĵ�����Һ����������Ϊ2NA |
| D��4.5 g SiO2�����к��еĹ�������ĿΪ0.3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.5mol��L��1 | B��1.5 mol��L��1 | C��0.4 mol��L��1 | D��0.25 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ռ�����һ����� | B������ԭ��������� |
| C����������������� | D��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A���ڷ�Ӧ5NH4NO3 2HNO3��4N2����9H2O�У�ÿ����4 mol N2��ת�Ƶ�����Ϊ10NA 2HNO3��4N2����9H2O�У�ÿ����4 mol N2��ת�Ƶ�����Ϊ10NA |
| B��12.5 mL 16 mol·L��1Ũ����������ͭ��Ӧ��ת�Ƶ�����Ϊ0.2NA |
| C����״���£�1.12L��SO3������ԭ����ԼΪ0.2NA |
| D����״���£�2.2gCO2����������������Ϊ0.05NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���� | B���� | C��п | D��þ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com