
科目:高中化学 来源: 题型:选择题
| A. | [A-]>[B+]>[H+]>[OH-] | B. | [B+]>[A-]>[H+]>[OH-] | C. | [B+]>[A-]>[OH-]=[H+] | D. | [A-]>[B+]>[OH-]>[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-4的溶液中:Na+、SiO32-、SO32-、K+ | |
| B. | 加入Al能放出H2的溶液中:Cl-、Mg2+、NO3-、K+ | |
| C. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:ClO-、Na+、SO32-、Cl- | |
| D. | pH=1的溶液中:Mg2+、Br-、K+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
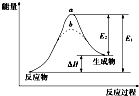
| A. | 逆反应的活化能小于正反应的活化能 | |
| B. | a、b分别对应有催化剂和无催化剂的能量变化 | |
| C. | 该反应的反应热△H=E2-E1 | |
| D. | 催化剂能改变反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CO完全燃烧生成CO2分子数为NA | |
| B. | 17g 氨气所含电子数为NA | |
| C. | 在常温、常压下,11.2L氯气所含的原子数目为NA | |
| D. | 32g氧气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com