
| A. | 2NO2+2NaOH═NaNO3+NaNO2+H2O | |
| B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 | |
| C. | CaH2+2H2O═Ca(OH)2+2H2↑ | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 立方相氮化硼含配位键B→N | |
| B. | 六方相氮化硼层间作用力小,所以质地软,熔点低 | |
| C. | 两种氮化硼中的硼原子都是采用sp2杂化 | |
| D. | 六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酚酞试纸 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 用硝酸银溶液 | D. | 用湿润的淀粉-KI试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 分别滴入几滴水,振荡,摸试管底部. | 试管a放热现象更明显(填“a”或“b”) |
| ③ | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象. | / |
| ④ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液均变红,颜色较深的试管是a(填“a”或“b”). |
| ⑤ | 最后分别向两溶液中滴加足量盐酸. | 红色褪去,均有无色气体产生.经计算生成气体的是a<b(填“>”“<”或“=”) |
| ⑥ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末)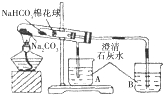 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10-8+10-10)mol•L-1 | B. | (10-4+10-6)mol•L-1 | ||
| C. | (10-6+10-10)mol•L-1 | D. | 2×10-10 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
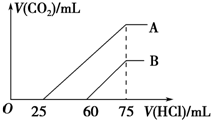 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )| A. | 在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3 | |
| B. | B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况) | |
| C. | 原NaOH溶液的物质的量浓度为0.100mol/L | |
| D. | B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为吸热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中仍充入1molA和1molB,反应达到平衡状态时,C的物质的量分数小于60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com