
硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如表所示。回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
c/mol·L-1 | 0 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
(1)计算该反应在120~180 s间的平均反应速率_________;比较120~180 s与180~240 s 区间的平均反应速率的大小,前者_________后者(填>,<或=),理由是____________________。
(2)计算15 ℃时该反应的平衡常数_____________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________。
A.加入O2NC6H4COOC2H5 B.增加OH-的浓度
C.移去产物 D.加入适当的催化剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:实验题
实验室需要配制0.50 mol/L NaCl溶液480 mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
Ⅰ.(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、__________、_________________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________ g。
(3)称量。
①天平调平。 ②称量。 ③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_______________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶中,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”)。
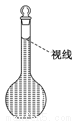
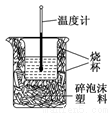
Ⅱ.实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处未画出,它们是________________,________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”);原因是_______________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。用湿润的淀粉碘化钾试纸检验气体时,试纸先变蓝后褪色。下列有关说法正确的是( )
A.由反应可确定:氧化性HClO4 >HClO3
B.该反应的还原产物是O2和HClO4
C、试纸先变蓝后褪色是因为Cl2具漂白性
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大压强,活化分子百分数增多,化学反应速率一定增大
B.升高温度,活化分子百分数不变,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
将等物质的量浓度、等体积的Ba(OH)2溶液与盐酸混合后,滴入紫色石蕊试液,溶液呈
A.紫色 B.红色 C.蓝色 D.无色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
2008年,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋天才奖”。下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.纯银质物品久置表面变暗,是银发生吸氧腐蚀的结果
D.钢板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-==Fe3+,继而形成铁锈
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:填空题
以食盐为原料进行生产并综合利用的某些过程如下图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A、图①可以表示对某化学平衡体系改变温度后反应速率的变化
B、图②中由于Mg比Al活泼,所以Mg为负极
C、图③可以表示向明矾溶液中滴加氢氧化钠溶液产生沉淀量的变化
D、图④可以表示足量锌粉与稀硫酸反应,加少量CuSO4固体产生H2的变化
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷(解析版) 题型:选择题
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL4mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.16 mol C.0.21 mol D.0.14 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com