
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |
分析 A.醋酸为弱电解质,应保留化学式;
B.一水合氨为弱电解质,应保留化学式;
C.氯气氧化性强于碘,能够氧化碘离子生成碘;
D.离子个数配比不符合物质的结构.
解答 解:A.醋酸溶液与水垢中的CaCO3反应,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+2CH3COO-+CO2↑,故A错误;
B.向盐酸中滴加氨水,离子方程式:H++NH3•H2O=H2O+NH4+,故B错误;
C.向KI溶液中通入少量Cl2反应生成碘和氯化钾,离子方程式:Cl2+2I-=2Cl-+I2,故C正确;
D.氢氧化钙溶液与等物质的量的稀硫酸混合,离子方程式:Ca2++2OH-+2H++SO4 2-=CaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确发生反应实质、熟悉物质化学式拆分规律是解题关键,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 17.6 g丙烷中所含的共价键数目为4NA | |
| B. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数目为0.5NA | |
| D. | 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
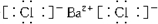 ,③的电子式是
,③的电子式是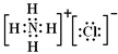 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com