
【题目】据《X-MOL》报道:RobertPipes等设计的添加PDS(![]() )的Li-CO2电池,正极物质转化原理如图所示。下列说法错误的是( )
)的Li-CO2电池,正极物质转化原理如图所示。下列说法错误的是( )

A.PDS起增强导电性作用
B.负极反应式为Li-e-=Li+
C.电池总反应为4Li+3CO2=2Li2CO3+C
D.正极上发生的反应之一为![]() +2CO2+2e-=2
+2CO2+2e-=2![]()
科目:高中化学 来源: 题型:
【题目】平衡体系mA(g)+nB(g)![]() pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
A.②④B.②③C.①④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323K,NaClO2溶液浓度为5×10-3molL-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO | SO | NO | NO | Cl- |
c/(molL-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___。增加压强,NO的转化率___(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___ (填“增大”、“不变”或“减小”)。
③由实验结果可知,脱硫反应速率脱硝反应速率___ (填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。
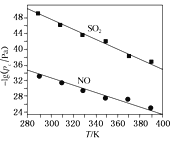
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___ (填“增大”、“不变”或“减小”)。
②反应ClO![]() +2SO
+2SO![]() =2SO
=2SO![]() +Cl-的平衡常数K表达式为___。
+Cl-的平衡常数K表达式为___。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法不正确的是

A.b为电源的负极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阴极移动D.理论上每消耗11.2 L O2,转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。下列说法错误的是

A.a点时溶液中金属阳离子有Fe3+、Cu2+和Fe2+
B.b点时溶液中的离子反应有两种
C.原溶液中n(Fe3+):n(Cu2+)=1:1
D.原溶液中Fe2(SO4)3的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其结构如图所示,A、B是多孔性碳制成的两个电极。
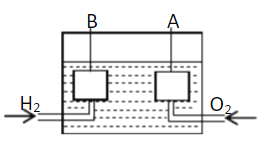
(1)该燃料电池的正极是 (填“A”或“B”),若电解质溶液为KOH溶液,则负极的电极反应式为 ;一段时间后,溶液的pH会 (填“变大”“变小”或“不变”)。
(2)若电解质溶液为硫酸,则正极的反应式为 。
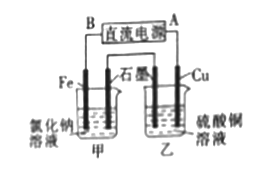
(3)若用该氢氧燃料电池作电源电解氯化钠溶液和硫酸铜溶液,装置如图所示,则铁电极上产生的气体为 (填化学式);一段时间后,铜电极的质量减少6.4g,则甲池中石墨电极上产生气体的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)________(填“>”“<”或“=”)v(逆),随后v(正)逐渐______(填“增大”或“减小”,下同),v(逆)逐渐________,反应达到平衡时,V(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则V(N2)=____v'(H2)。
(3)下列措施中不能加快反应速率的是___________(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氦气
(4)写出合成氨反应N2+3H2![]() 2NH3的平衡常数表达式:_____________________________。
2NH3的平衡常数表达式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的定容密闭容器中,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g), 下列哪种情况,能表明反应达到平衡状态
2SO3(g), 下列哪种情况,能表明反应达到平衡状态
A. SO2速率是O2速率的2倍
B. SO3的浓度是O2浓度的2倍
C. SO3的质量分数保持不变
D. 单位时间内SO2消耗的浓度等于SO3生成的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有![]() 和N5-两种离子)的重要中间体。下列说法中不正确的是( )
和N5-两种离子)的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源B.每个N5+中含有5个原子核
C.每N5-中含有36个质子D.N10结构中含非极性共价键和离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com