
下列说法不正确的是
A.氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个
B.分子晶体中有范德华力,也有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
科目:高中化学 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol· L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
斯坦福大学B.M. Trost教授提出了绿色化学的核心概念——原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:
原子利用率= ×100%
×100%
下面是新型自来水消毒剂ClO2的四种生产方法,请填空:
(1)氯酸钠和盐酸法:本方法的方程式为2NaClO3+4HCl===2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数,下同)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62.2%,其阳极电极反应式为:ClO -e-===ClO2,阴极电极反应式为_______________。
-e-===ClO2,阴极电极反应式为_______________。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53.6%,此反应的化学方程式为____________________________________。
(4)联合工艺法:本方法的反应原理由三步组成:
①电解氯化钠溶液NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯2NaClO3+4HCl===2NaCl+2ClO2↑+Cl2↑+2H2O此方法的原子利用率最大为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A.①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B.晶胞中原子的配位数分别为:①6, ②8 ,③8, ④12
C.金属镁采取③的堆积方式
D.空间利用率的大小关系为:① < ② < ③ < ④
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属晶体M有两种堆积形式,如下图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同。


甲 乙
(1)乙的堆积方式称为 堆积;
甲和乙两种堆积方式中配位数之比为 ,
晶胞边长之比为 。
(2)在T℃以下测定该金属晶体有关性质参数如下表所示。已知原子化热指1mol金属由固态转变为气态原子时所需要吸收的热量,是衡量金属键强弱的物理量。
| 金属 | 相对原子质量 | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22. 99 | 0. 960 | 108. 4 |
| M | 60. 20 | 7. 407 | 7735 |
预测该金属的熔点比Na (填“高”或“低”),由上述数据可计算M原子的原子半径为 pm。
(已知 ,7. 407≈
,7. 407≈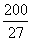 ,1pm=10
,1pm=10 m)
m)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②④
C.②③④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com