
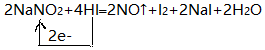 .
.分析 (1)NaNO2→NO,氮元素化合价升高,NaNO2是氧化剂;
(2)NaNO2→NO,氮元素化合价升高,根据钠元素守恒,生成物还有NaI,HI→I2,碘元素化合价升高,根据氢元素守恒,生成物中还有水,最后根据化合价升降相等配平和计算转移电子数;
(3)由2NaNO2+4HI═2NO↑+I2+2NaI+2H2O可知,HI即表现酸性也表现还原性,其中表现酸性和还原性的物质的量相同;
(4)在NaNO2会导致血红蛋白中Fe2+转化为Fe3+而中毒反应中,氧化剂为NaNO2,被还原,还原剂为Fe2+,
在服用维生素C可以解除NaNO2的中毒反应中,维生素C把Fe3+还原为Fe2+,作还原剂;
(5)鉴别NaNO2和NaCl,可根据NaNO2在酸性条件下具有氧化性,用淀粉碘化钾试纸来检验.
解答 解:(1)NaNO2→NO,氮元素化合价升高,NaNO2是氧化剂,NO是还原产物,
故答案为:NaNO2;
(2)NaNO2→NO,氮元素化合价升高,根据钠元素守恒,生成物还有NaI,则HI→I2,碘元素化合价升高,根据氢元素守恒,生成物中还有水,反应方程式为2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,转移电子数为2×【(+3)-(+2)】=2×【0-(-1)】=2,单线桥表示为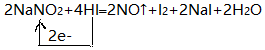 ,
,
故答案为: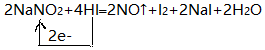 ;
;
(3)HI即表现酸性也表现还原性,其中表现酸性和还原性的物质的量相同,因此
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O
2 2(还原剂)
0.25mol 0.25mol
故答案为:0.25 mol;
(4)在NaNO2会导致血红蛋白中Fe2+转化为Fe3+而中毒反应中,氧化剂为NaNO2,被还原,还原剂为Fe2+,
在服用维生素C可以解除NaNO2的中毒反应中,维生素C把Fe3+还原为Fe2+,作还原剂;
A.NaNO2是氧化剂,故A错误;
B.维生素C是还原剂,故B正确;
C.维生素C把Fe3+还原为Fe2+,故C错误;
D.在NaNO2会导致血红蛋白中Fe2+转化为Fe3+而中毒反应中,氧化剂为NaNO2,被还原,故D错误;
故答案为:B;
(5)鉴别NaNO2和NaCl溶液,可根据NaNO2在酸性条件下具有氧化性,发生反应2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,用淀粉碘化钾试纸来检验,可加入醋酸酸化,
故答案为:②⑤.
点评 本题以NaNO2为载体考查氧化还原反应以及物质的检验等知识,题目难度中等,答题时注意把握题给信息为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| B. | Y的氢化物比R的氢化物稳定,沸点高 | |
| C. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com