
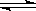 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1| A.加入V2O5做催化剂 | B. 使用过量SO2 使用过量SO2 | C.高温 | D.通入过量空气 |
科目:高中化学 来源:不详 题型:填空题
 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表 :
:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
 >
>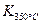 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ,下列叙述中是反应达到平衡的标志的是( )
2C(g) ,下列叙述中是反应达到平衡的标志的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是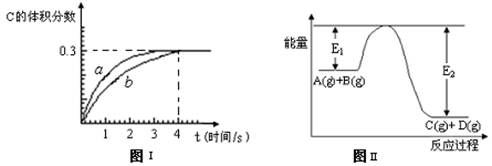

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
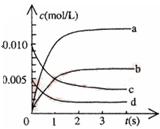
 2Z(g) ΔH< 0反应变化过程中物质的浓度与反应的时间变化关系.图中t2→t3秒间的曲线变化是由于下列哪种条件的改变所引起的
2Z(g) ΔH< 0反应变化过程中物质的浓度与反应的时间变化关系.图中t2→t3秒间的曲线变化是由于下列哪种条件的改变所引起的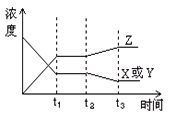
| A.增大了压强 | B.降低温度 |
| C.增加了x和y的浓度 | D.使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+H2(g),一段时间后达到平衡。对该平衡状态描述正确的是
CO2(g)+H2(g),一段时间后达到平衡。对该平衡状态描述正确的是| A.正反应速率等于零 | B.正反应速率大于逆反应速率 |
| C.正反应速率等于逆反应速率 | D.正反应速率小于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: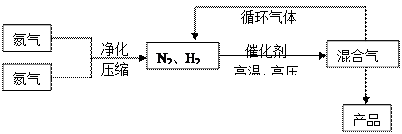
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
| A.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
B.保持温度和活塞位置不变,在甲中 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
D.保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com