
| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
分析 先依据n=$\frac{m}{M}$计算原子的物质的量,再由阴离子Xn-核外有x个电子,则质子数为x-n,利用质子数与中子数之和等于质量数来计算中子数;
解答 解:元素原子的质量数为A,w克这种元素的原子,其物质的量为$\frac{w}{A}$mol,
阴离子Xn-核外有x个电子,则质子数为x-n,
原子核内中子数为A-(x-n)=A-x+n,
则w克这种元素的原子核内中子数为$\frac{W}{A}$mol×(A-x+n)=$\frac{W(A-x+n)}{A}$mol,
故选:C.
点评 本题考查了有关物质的量的计算,明确以物质的量为核心的计算公式,熟悉原子中各微粒之间数量关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓ | |
| B. | FeCl3+3NaOH=Fe(OH)3↓+3NaCl | |
| C. | Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓ | |
| D. | FeCl2+2KOH=Fe(OH)2↓+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
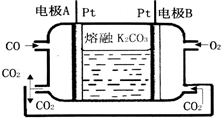 碳及其化合物与人类生产、生活密切相关.
碳及其化合物与人类生产、生活密切相关.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com