
下列各项叙述中,正确的是( )。
A.镁原子由 1s22s22p63s2→1s22s22p63p2 时,原子释放能量,由基态转化成激发态
B.价电子排布为 5s25p1 的元素位于第五周期第ⅠA 族,是 s 区元素
C.所有原子任一能层的 s 电子云轮廓图都是球形,但球的半径大小不同
D.24Cr 原子的电子排布式是1s22s22p63s23p63d44s2
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
水的电离过程为H2O
 H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2·L-2,K(35℃)=2.1×10-14 mol2·L-2。则下列叙述不正确的是( )
H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2·L-2,K(35℃)=2.1×10-14 mol2·L-2。则下列叙述不正确的是( )
A.纯水的pH随着温度的升高而降低
B.在35℃时,[H+]>[OH-]
C.在25℃和35℃时,[H+]=[OH-]
D.水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)
 Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2 B.NaOH C.MgSO4 D.NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g)
 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol的A2,同时生成n mol的AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol的AB同时生成n mol的B2
D.平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应aA(g)+bB(g)
 cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系:
cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系: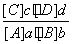 =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)若升高温度到950℃,达到平衡K________(填“大于”、“小于”或“等于”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分前36号元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X |
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是_____________。
(2)S元素的常见化合价为________,原因是__________________________。
(3)T元素的原子N能层上电子数为________。
(4)X的核外电子排布图违背了________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示:

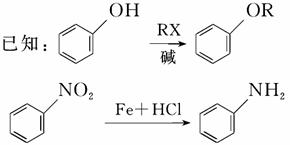
完成下列填空:
(1)写出反应类型:
反应③________;反应④________。
(2)写出结构简式:
A_____________________________________________________________;
E__________________________________________________________。
(3)写出反应②的化学方程式:_______________________________________
_________________________________________________________________。
(4)B的含苯环结构的同分异构体中,有一类能发生碱性水解,写出检验这类同分异构体中的官能团(酚羟基除外)的试剂及出现的现象:
试剂(酚酞除外):___________________________________________;
现象:_____________________________________________________。
(5)写出两种C的含苯环结构且只含4种不同化学环境氢原子的同分异构体的结构简式:
_________________________________________________________
_________________________________________________________。
(6)反应①、反应②的先后次序不能颠倒,请解释原因:_________________
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.溶度积大的化合物溶解度肯定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中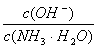 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com