
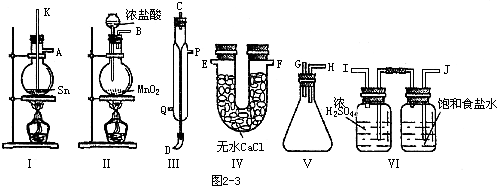
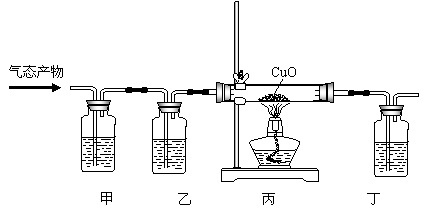
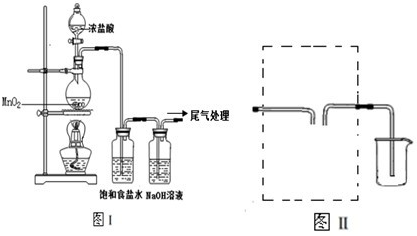
| A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母) ( )接( )、( )接( )、( )接( )、( )接( )、( )接( ); |
| B.装置Ⅵ作用是______;装置Ⅳ的作用是______; |
| C.冷凝管里冷水的流向是从______进入,从________流出; |
| D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热; |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
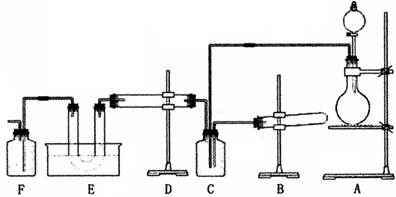
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
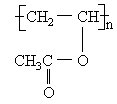
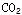 和CO;
和CO;| | |
| |  |
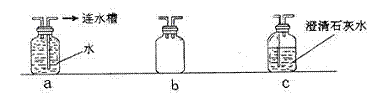
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入铜片 | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | ______ | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com