
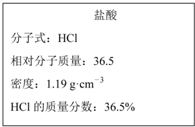
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:分析 (1)根据c=$\frac{1000ρω}{M}$计算该浓盐酸中HCl的物质的量浓度;
(2)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据溶液稀释定律C浓V浓=C稀V稀来计算,根据量筒的选取原则是大而近选取量筒;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)质量分数36.5%,密度为1.19g/mL的盐酸的物质的量浓度=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L,
故答案为:11.9;
(2)操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故上述仪器中需要使用的有①③⑤;根据提供的仪器可知,还需仪器有:100ml容量瓶、玻璃棒,
故答案为:①③⑤;100 mL容量瓶、玻璃棒;
(3)设需要的浓盐酸的体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:11.9mol/L×VmL=1mol/L×100mL,解得V≈8.4mL,由于量取的浓盐酸的体积为8.4ml,根据量筒的选取原则是大而近,故选用10ml的量筒,
故答案为:8.4;①;
(4)A.未经冷却,立即转移至容量瓶并洗涤烧杯并定容,则冷却后溶液体积偏小,浓度偏高,故A正确;
B.量取浓盐酸时仰视量筒刻度线,则所取的浓硫酸的体积偏大,所配溶液的浓度偏高,故B正确;
C.烧杯没有洗涤,造成溶质的损失,则浓度偏低,故C错误;
D.某同学在定容观察液面时俯视,则溶液体积偏小,浓度偏高,故D正确;
E.定容后经振荡、摇匀、静置,发现液面下降,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于100ml,溶液浓度偏低,故E错误;
G.容量瓶中原来含有少量蒸馏水,未进行干燥处理,对溶质的物质的量、最终溶液的体积都无影响,所以不影响溶液浓度,故G错误;
故答案为:ABD.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大,试题培养了学生的分析能力及化学检验能力.


科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
混合气体由CH4和N2组成,测得混合气体在标准状况下的密度为0.893g/L,则混合气体中N2和CH4的体积之 比为
比为
A.1:2 B.1:4 C.2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴定操作中,滴定管和锥形瓶都需要用待装溶液润洗 | |
| B. | 酸性溶液中,Fe2+、SO2-4、K+、NO-3能大量共存 | |
| C. | SO2具有漂白性,将其通人石蕊溶液中,溶液先变红后褪色 | |
| D. | 常用丁达尔效应区分溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量0.40g NaOH固体,在烧杯中加入100mL 水溶解即可 | |
| B. | 将称量好的固体NaOH放入100 mL容量瓶中,加蒸馏水溶解至环形刻线 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液冷却到室温后,转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com