
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 ;
;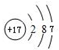 ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.
分析 A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8-2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl.
(1)①主族元素周期数=电子层数、族序数=最外层电子数;
②C单质为N2,分子中氮原子之间形成3对共用电子对;
③Cl原子核外电子数为17,结合核外电子排布规律书写;
④Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成;
(2)元素氢化物稳定性,元素最高价含氧酸的酸性强弱,单质之间的相互置换等可以判断元素非金属性强弱;
(3)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,
①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4,SO2被H2O2氧化为硫酸,硫酸与氯化钡反应生成硫酸钡与盐酸;
②若Z是红棕色气体,则Z为NO2,则X为N2、Y为NO、W为HNO3,则Z→W的反应为3NO2+H2O=2HNO3+NO,结合氮元素化合价变化判断.
解答 解:A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8-2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl.
(1)①A为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
②C单质为N2,分子中氮原子之间形成3对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
③Cl原子核外电子数为17,原子结构示意图为 ,故答案为:
,故答案为: ;
;
④Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成过程为: ,
,
故答案为: ;
;
(2)Cl元素非金属性比硫的强,
a.常温下单质的状态属于物理性质,不能用以判断非金属性的强弱,故a错误;
b.D的氢化物比A的氢化物稳定,说明D的非金属性较强,故b正确;
c.一定条件下D和A的单质都能与钠反应,说明都具有氧化性,但不能说明非金属性的强弱,故c错误;
d.A的最高价含氧酸酸性弱于D的最高价含氧酸,说明D的非金属性较强,故d正确;
e.D单质能与A的氢化物反应生成A单质,说明D的非金属性较强,故e正确.
故答案为:Cl:bde;
(3)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,
①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4,SO2通入BaCl2溶液中,然后滴加适量H2O2溶液,SO2被氧化性为硫酸,发生反应:SO2+H2O2=H2SO4,硫酸与氯化钡反应生成硫酸钡与盐酸,白色沉淀为BaSO4,该反应的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl,
故答案为:BaSO4;SO2+H2O2=H2SO4;
②若Z是红棕色气体,则Z为NO2,则X为N2、Y为NO、W为HNO3,则Z→W的反应为3NO2+H2O=2HNO3+NO,反应中二氧化氮是氧化剂、还原剂,起氧化剂的二氧化氮生成NO,起还原剂的二氧化氮生成硝酸,故氧化剂与还原剂物质的量之比=1:2,
故答案为:1:2.
点评 本题考查结构性质位置关系应用、无机物推断等,明确元素种类是解答的关键,侧重考查常用化学用语及元素化合物性质,注意掌握非金属性、金属键强弱比较规律,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核外每一个能层最多可容纳的电子数为n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数等于该能层数 | |
| C. | 不同能层中s电子的原子轨道半径相同 | |
| D. | 不同能层中p电子的原子轨道能量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N 与14N 互为同位素 | D. | 232Th转化成233U是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 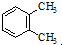 与 与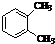 是同分异构体 是同分异构体 | |
| B. | 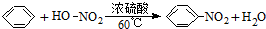 此反应是取代反应 此反应是取代反应 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z能形成Z2Y和Z2Y2两种不同的化合物,它们的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
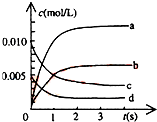 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-(CH2)11C6H4-SO3Na | B. | CH3-(CH2)13-COOK | ||
| C. | CH3-(CH2)11-SO3Na | D. | CH3(CH2)nCH3(5≤n≤12) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com