
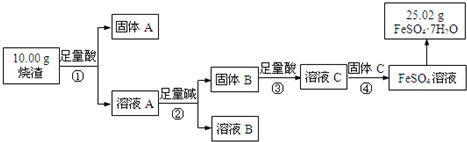
分析 烧渣主要成份为Fe2O3、Al2O3和SiO2,不考虑其他杂质,与足量酸混合,离子反应方程式为Fe2O3+6H+=2Fe3++3H2O、Al2O3+6H+=2Al3++3H2O;
SiO2和酸不反应,然后过滤得到的固体A为SiO2,溶液A中含有H+、Al3+、Fe3+,加入足量碱,发生的反应为Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,然后过滤得到的滤液B中含有偏铝酸盐和碱,固体B为Fe(OH)3,B和稀硫酸反应生成Fe2(SO4)3,C中含有硫酸和硫酸铁,加入固体C,为防止引入杂质,则固体C为Fe,发生氧化还原反应生成硫酸亚铁,然后蒸发浓缩、冷却结晶、过滤得到绿矾,
(1)分离难溶性固体和溶液采用过滤方法;
(2)③中为氢氧化铁和酸的反应;
(3)a.①的目的是溶解金属氧化物,③的目的是得到硫酸盐;
b.B中不含硅酸根离子;
c.加入Fe的目的是还原铁离子;
(4)n[FeSO4•7H2O]=$\frac{25.02g}{278g/mol}$=0.09mol,根据2Fe3++Fe=3Fe2+知,有$\frac{2}{3}$的亚铁离子来自于铁离子,所以根据Fe原子守恒得n(Fe2O3)=$\frac{1}{2}$×$\frac{2}{3}$×n[FeSO4•7H2O]=$\frac{1}{2}$×$\frac{2}{3}$×0.09mol=0.03mol,m(Fe2O3)=0.03mol×160g/mol=4.8g,根据质量分数公式计算其质量分数.
解答 解:烧渣主要成份为Fe2O3、Al2O3和SiO2,不考虑其他杂质,与足量酸混合,离子反应方程式为Fe2O3+6H+=2Fe3++3H2O、Al2O3+6H+=2Al3++3H2O,;
SiO2和酸不反应,然后过滤得到的固体A为SiO2,溶液A中含有H+、Al3+、Fe3+,加入足量碱,发生的反应为Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,然后过滤得到的滤液B中含有偏铝酸盐和碱,固体B为Fe(OH)3,为防止引进杂质,酸用稀硫酸,B和稀硫酸反应生成Fe2(SO4)3,C中含有硫酸和硫酸铁,加入固体C,为防止引入杂质,则固体C为Fe,发生氧化还原反应生成硫酸亚铁,然后蒸发浓缩、冷却结晶、过滤得到绿矾,
(1)通过以上分析知,采用过滤方法分离的是①②,故答案为:①②;
(2)氢氧化铁和酸反应生成铁盐和水,离子方程式为Fe(OH)3+3H+=Fe3++3H2O,故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(3)a. ①的目的是溶解金属氧化物,③的目的是得到硫酸盐,所以①中可选用盐酸,③中只能用硫酸,
,故正确;
b.通过以上分析知,溶液B中含有OH-、AlO2-,不含硅酸根离子,故错误;
c.④中发生了氧化还原反应,固体C做还原剂,失电子发生氧化反应,故正确;
故选ac;
(4)n[FeSO4•7H2O]=$\frac{25.02g}{278g/mol}$=0.09mol,根据2Fe3++Fe=3Fe2+知,有$\frac{2}{3}$的亚铁离子来自于铁离子,所以根据Fe原子守恒得n(Fe2O3)=$\frac{1}{2}$×$\frac{2}{3}$×n[FeSO4•7H2O]=$\frac{1}{2}$×$\frac{2}{3}$×0.09mol=0.03mol,m(Fe2O3)=0.03mol×160g/mol=4.8g,氧化铁质量分数=$\frac{4.8g}{10.00g}×$100%=48.00%(或0.48),
故答案为:48.00%(或0.48).
点评 本题考查物质制备,为高频考点,侧重考查学生分析推断及综合应用能力,明确流程图中发生的反应及物质分离提纯方法是解本题关键,注意原子守恒的灵活运用,注意绿矾中Fe元素来源,为易错点.


科目:高中化学 来源: 题型:选择题
| A. |  装置用于检验消去产物 | B. | 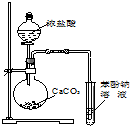 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 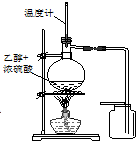 装置用于实验室制取并收集乙烯 | D. | 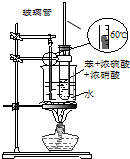 装置用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
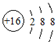 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )| A. | 核电荷数为18 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素的原子 | D. | 在化学反应中易得2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.从碘水中提取碘单质 | C.从食盐水中获取氯化钠 | D.用自来水制取蒸馏水 |
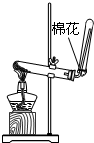 | 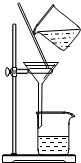 | 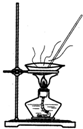 | 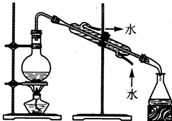 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
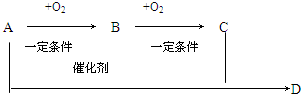 根据如图有机物的转化关系回答.已知A是乙醇.
根据如图有机物的转化关系回答.已知A是乙醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物中不可能存在非极性共价键 | |
| B. | 由电子定向移动而导电的物质一定是金属晶体 | |
| C. | 有键能很大的共价键存在的物质熔沸点一定很高 | |
| D. | 只含有共价键的物质不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
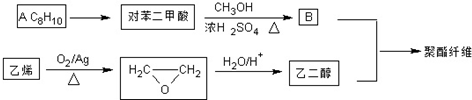
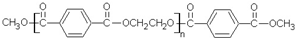 若乙二醇过量,则生成的聚酯纤维可表示为
若乙二醇过量,则生成的聚酯纤维可表示为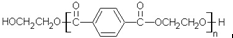 .
.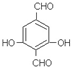 .
.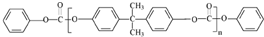 合成PC的2种单体的中:醇(或酚)的结构简式为
合成PC的2种单体的中:醇(或酚)的结构简式为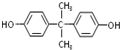 ,酯的名称为碳酸二苯酚酯.
,酯的名称为碳酸二苯酚酯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com