
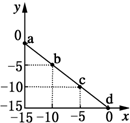
 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )| A. | 该温度高于25℃ | |
| B. | 图中a点溶液呈碱性 | |
| C. | 该温度下,0.01 mol•L-1的HCl溶液中,由水电离出的H+浓度为10-12 mol•L-1 | |
| D. | 该温度下,等体积浓度均为0.01 mol•L-1的HCl溶液与NaOH溶液恰好完全反应的pH=7 |
分析 A.温度越高水的电离程度越大,水的离子积增大,由Kw=c(H+).c(OH-)计算判断;
B.图中a点溶液c(OH-)=1mol/L,c(H+)=10-15,则c(OH-)>c(H+);
C.水电离出的H+浓度等于溶液中氢氧根离子浓度,根据Kw=c(H+).c(OH-)计算;
D.由图可知Kw=10-15,溶液呈中性时pH=7.5.
解答 解:A.根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15<10-14,所以该温度低于25℃,故A错误;
B.图中a点溶液c(OH-)=1mol/L,c(H+)=10-15,c(OH-)>c(H+),溶液呈碱性,故B正确;
C.水电离出的H+浓度等于溶液中氢氧根离子浓度,该温度下Kw=10-15,则水电离出的H+浓度为c(H+)=$\frac{1{0}^{-15}}{1{0}^{-2}}$mol/L=10-13mol/L,故C错误;
D.该温度下Kw=10-15,溶液呈中性时c(OH-)=c(H+),则溶液中c(H+)=10-7.5,则中性时溶液pH=7.5,故D错误.
故选B.
点评 本题考查溶液pH的有关计算、水的离子积,注意对水的离子积的理解,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
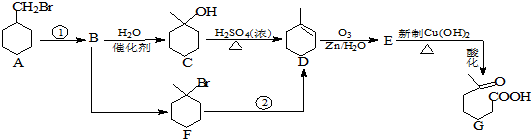
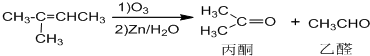
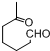 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$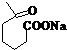 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.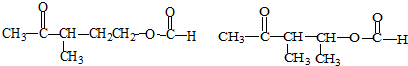
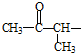 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应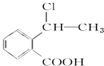 为原料制备
为原料制备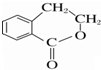 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | B. | 2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ | ||
| C. | 2CO+O2═2CO2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的过程主要有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
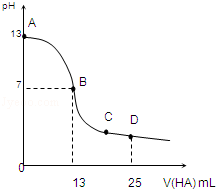 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com