


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
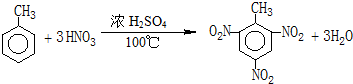
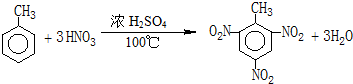
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁盘锦第二高中高一第二次阶段考试化学试卷(带解析) 题型:填空题
(10分)从氧化还原反应的角度看
(1)在制备下列三种气体时,盐酸起什么作用:(填序号)
①制备H2 Zn + 2HCl =ZnCl2 + H2 ↑ 盐酸起 作用
②制备Cl2 MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑ 盐酸起 作用
③制备CO2 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 盐酸起 作用
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修5 4.3蛋白质和核酸练习卷(解析版) 题型:填空题
下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图.
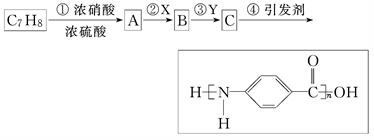
回答下列问题:
(1)聚酰胺类物质所具有的结构特征是________.(用结构简式表示)
(2)反应①通常应控制的温度为30℃左右,在实际生产过程中应给反应体系加热还是降温?为什么?____________________________________________________.若该反应在100℃条件下进行,则其化学反应方程式为_________________________________.
(3)反应②和反应③从氧化还原反应的角度看是________基团被氧化为________基团,________基团被还原为________基团.从反应的顺序看,应先发生氧化反应还是还原反应?为什么?_______________________________________________________________
_______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com