
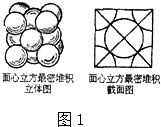
 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是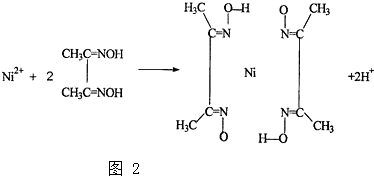
| m |
| V |
| 6 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 8 |
| 2 |
| m |
| V |
| ||
16
|
| ||
| 8d3NA |
| ||
| 8d3NA |
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、NH4++H2O?NH3?H2O+H+ |
| B、HCO3-+H2O?H3O++CO32- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
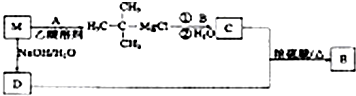
查看答案和解析>>
科目:高中化学 来源: 题型:
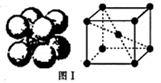 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.| A是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离分别是:I1=738kJ?mol-1 I2=1451kJ?mol-1 I3=7733kJ?mol-1 I4=10540kJ?mol-1 |
| D原子核外所有p轨道全充满或半充满 |
| E元素基态原子的核外电子排布为1s22s22p63s23p5 |
| F元素基态原子是前四周期中未成对电子数最多的元素 |
| G在周期表的第8列 |
| H元素原子价电子排布式为3d104s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
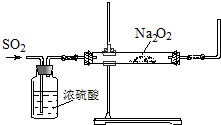
| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | 待硬质玻管冷却到室温后,用药匙取少量白色固体于试管中. | / |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
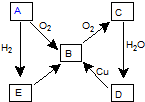 图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).
图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com