
已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
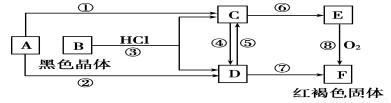
(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________,
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:
⑧
④
⑤
(1)Fe Fe3O4 FeCl2 FeCl3 Fe(OH)2 Fe(OH)3 (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3,
2Fe2++Cl2=2Fe3++2Cl-,2Fe3++Fe=3Fe2+
【解析】
试题解析:(1)E被氧气氧化生成红褐色固体F,则F是Fe(OH)3,E是Fe(OH)2,根据元素守恒知,A单质是Fe,黑色晶体B和盐酸反应生成C和D,A能发生反应生成C和D,B是黑色晶体且含有铁元素,能和盐酸反应生成两种不同的盐,则B是Fe3O4,C是FeCl2,D为FeCl3,E是Fe(OH)2;(2)⑧ F是Fe(OH)3,E是Fe(OH)2,氢氧化亚铁不稳定,在空气中易被氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;④C是氯化亚铁,D是氯化铁,氯化亚铁和氯气反应生成氯化铁,离子反应方程式为:2Fe2++Cl2═2Fe3++2Cl-;⑤氯化铁和铁反应生成氯化亚铁,离子反应方程式为:Fe+2Fe3+═3Fe2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列叙述正确的是
A.18gH2O中含有的质子数为NA
B.常温常压下,Na2O2与足量H2O反应,每生成1 molO2,转移电子的数目为4NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.物质的量浓度为0.5 mol·L-1的MgCl2的溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
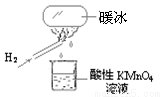
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
A.NaAlH4中含有离子键和非极性共价键
B.每生成11. 2 L(标准状况下)H2,转移NA个电子
C.NaAlH4中氢元素为+1价,在反应中有50%的氢被还原
D.反应中氧化产物与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①原溶液中Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A.②③④ B.①②③ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列解释事实的化学方程式或离子方程式,不正确的是
A.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2===2HClO+CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) CaCO3(s) + Na2SO4(aq)
CaCO3(s) + Na2SO4(aq)
D.工业上可用电解法制备Mg:MgCl2(熔融)  Mg + Cl2↑
Mg + Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:填空题
(14分)
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
反应C+G B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列说法正确的是()
A.同体积、同密度的C2H4和C3H6所含原子数一定相等
B.同主族元素的最高正价都相同
C.CH3COONa和NaOH中化学键类型完全相同
D. 最外层有5个电子的原子都是非金属原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com