
下列有关利用乙醛制备银镜过程的说法不正确的是
A.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水至最初的沉淀恰好溶解为止
B.将几滴银氨溶液滴入2 mL乙醛中
C.将盛有乙醛与银氨溶液混合液的试管置于热水浴中加热
D.在银氨溶液的配制过程中溶液pH增大
科目:高中化学 来源: 题型:
合成P(一种抗氧剂)的路线如下:

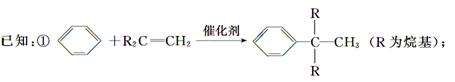
②A和F互为同分异构体,A分子中有三个甲基,F分子中只有一个甲基。
(1)A—→B的反应类型为________。B经催化加氢生成G(C4H10),G的化学名称是________。
(2)A与浓HBr溶液一起共热生成H,H的结构简式为______________。
(3)实验室中检验C可选择下列试剂中的________。
a.盐酸 b.FeCl3溶液
c.NaHCO3溶液 d.浓溴水
(4)P与足量NaOH溶液反应的化学反应方程式为__________________(有机物用结构简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
|
| A. | 常温常压下,23g的NO2含有的氧原子数为NA |
|
| B. | 已知某种元素的一种原子的质量为ag,则该元素的相对原子质量近似为aNA |
|
| C. | 某密闭容器盛有0.1molN2和0.4molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
|
| D. | 80gNH4NO3晶体中含有NH4+小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )
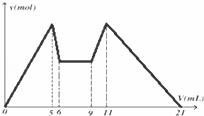
|
| A. | 可能是NaOH,B可能是盐酸,且2C(A)=C(B) |
|
| B. | 若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B |
|
| C. | A可能是Ba(OH)2,B可能是硫酸,且C(A)=C(B) |
|
| D. | 原混合液中,c(Al3+):c(Mg2+):c(Cl﹣)=1:2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > >
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O
①写出第二步反应的离子方程式
②工业生产时需在反应物中加少量Cl﹣,其作用是
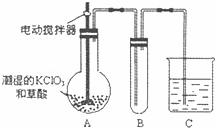
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸在60℃时反应制得,ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置
②C中应装的试剂为 C中发生反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
某小分子抗癌药物的分子结构如题5图所示,下列说法正确的是
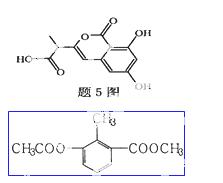
A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性:Cl2>Fe3+>SO2,某
小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
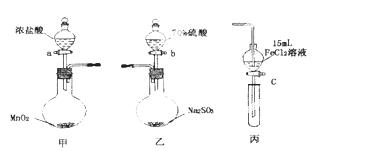
实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
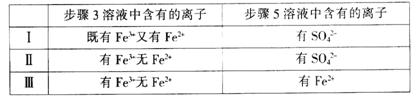
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列做法不正确的是( )。
A.易燃试剂与强氧化性试剂分开放置并远离火源
B.用湿润的红色石蕊试纸检验氨气
C.在50 mL量筒中配制0.1000 mol·L-1碳酸钠溶液
D.金属钠着火时,用细沙覆盖灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com