
(1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是 (填序号),理由是 该反应既 .
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(l)+8H2O(l)△H>0
C.CaC2(s)+2H2O(l)═Ca(OH)2(s)+C2H2(g)△H<0
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H<0
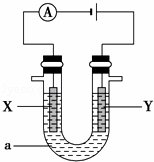
(2)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时,检验Y电极反应产物的方法是 .
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为 .
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
(1)构成原电池的条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,能自发的进行氧化还原反应时,该反应必须是放热反应;
(2)①电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子生成氯气,根据氯气的性质检验氯气;
②若X、Y分别为石墨和铁,Y为阳极,阳极上Fe失电子生成Fe2+,X为阴极,阴极生成氢氧根离子,电解过程中生成的氢氧化亚铁被氧气氧化为氢氧化铁.
解答:
解:(1)A:原电池反应是放热的氧化还原反应,放热反应的△H<0,故A错;
B:该反应不是氧化还原反应,且为吸热反应,故B错;
C:由于生成物Ca(OH)2微溶于水,会附着在反应物CaC2表面,反应难以继续,并且该反应不是氧化还原反应,故C错;
D:该反应是自发的氧化还原反应,且为放热反应,故D正确;
故答案为:D;该反应既是放热反应,又是氧化还原反应;
(2)①电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子生成氯气,氯气能使湿润的淀粉KI试纸变蓝色;
故答案为:将湿润的淀粉KI试纸放置于Y电极支管口处,试纸变蓝;
②若X、Y分别为石墨和铁,Y为阳极,阳极上Fe失电子生成Fe2+,X为阴极,阴极生成氢氧根离子,电解过程中生成的氢氧化亚铁被氧气氧化为氢氧化铁,所以电解过程中生成的白色固体物质露置在空气中可观察到的现象为白色固体迅速变为灰绿色最后变为红褐色;
故答案为:白色固体迅速变为灰绿色最后变为红褐色.
点评:
本题考查了原电池原理和电解原理的分析应用,主要是电极反应产物的判断及物质的检验,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是()
A. 在含铁元素较多的酸性土壤中
B. 在潮湿疏松透气的土壤中
C. 在干燥致密不透气的土壤中
D. 在含碳粒较多、潮湿透气的土壤中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关氧化还原反应的说法正确的是( )
A.浓盐酸在化学反应中既可以作氧化剂,又可以作还原剂
B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C.在任何条件下都不能发生反应:Cu + H2SO4====CuSO4+ H2↑
D.亚氯酸可发生分解反应:HClO2→ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e﹣═Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥.
|
| A. | ①③ | B. | ②③④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一处于平衡状态的可逆反应:X(s)+3Y(g)⇌2Z(g)(△H<0).为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z.
|
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知,单质碘受热易升华.从海带中提取碘的实验过程中,涉及下列实验操作步骤,关于各步骤的实验目的或实验操作,描述正确的是( )
|
| A. |
将海带灼烧成灰 | B. |
过滤得含I﹣的溶液 |
|
| C. |
下层放出碘的苯溶液 | D. |
分离碘并回收苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL 1.00mol•L﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol•L﹣1 Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL,1.00mol•L﹣1盐酸恰好完全中和.
求:
(1)n(CO2)= mol;
(2)m(Na2SO4)= g;
(3)m(NaHCO3)= g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com