
己知在1×105Pa、298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2(g)+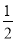 O2(g)=H2O(g) △H=+242kJ·mol-1
O2(g)=H2O(g) △H=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ·mol-1
C.H2O(g)=H2(g)+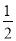 O2(g) △H=+242kJ·mol-1
O2(g) △H=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1.
科目:高中化学 来源:2016-2017学年四川省高二上期中化学卷(解析版) 题型:实验题
影响化学反应速率的因素很多,同学们用以下实验的进行探究。
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同)。
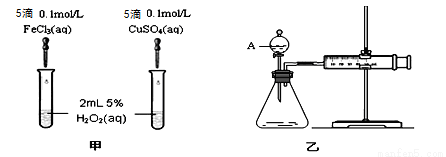
①定性分析:如图甲可通过观察产生气泡的快慢来比 较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性 。实验中需要测量的数据是: 。
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
① 写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式: 。
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外, 还需要选择的试剂最合理的是 。(填序号)
还需要选择的试剂最合理的是 。(填序号)
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
实验编号 | ① | ② | ③ | ④ | ⑤ |
温度(℃) | 30 | 40 | 50 | 60 | 70 |
显色时间(s) | 160 | 80 | 40 | 20 | 10 |
① 该反应的离子方程式为_____________________。
② 完成此实验,试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是______________,
实验现象为 。
③ 由上述实验记录数据可得出的结论是_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省嘉兴市七校高一上期中化学试卷(解析版) 题型:选择题
某原子含有6个电子、7个中子,它的化学符号为( )
A. 13C B. 13Al C. 13C D. 13Al
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:选择题
在一个体积恒定的密闭容器中,N2与H2反应合成氨的反应达到平衡后,容器中含 1molN2, 3molH2,1molNH3,保持温度不变,向该容器中再加1mol N2, 3mol H2,1molNH3,下列说法正确的是
A、正、逆反应速率同时增大,平衡不移动
B、正、逆反应速率同时增大,NH3百分含量增大
C、正.逆反应速率不变,平衡不移动
D、正反应速率增大,逆反应速率减小,平衡向逆反应移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:选择题
向少量FeCl3溶液中滴入KSCN溶液,发生反应:FeCl3+3KSCN Fe(SCN)3+3KCl。欲使试管内溶液红色变浅,下列措施合理的是
Fe(SCN)3+3KCl。欲使试管内溶液红色变浅,下列措施合理的是
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体
A.①② B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
关于0.1mol/L Na2CO3溶液的叙述错误的是( )
A.0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L
B.1 L该溶液中含有Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市红桥区高一上学期期中化学试卷(解析版) 题型:选择题
下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
A.CO2+H2O=H2CO3 B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上月考三化学试卷(解析版) 题型:填空题
下列是铝的两种重要化合物的生产制备:
I.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe 、Mg杂质)制备明矾的过程如下图所示。
、Mg杂质)制备明矾的过程如下图所示。
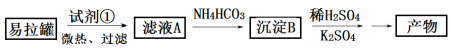
回答下列问题:
(1)为了少引入杂质,试剂①应选用___________(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)沉淀B的化学式为____________;将少量明矾溶于水,溶液呈弱酸性,其原因是______________。
II.以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如下图所示:
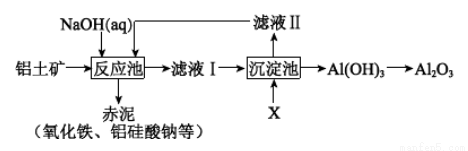
(1)Al2O3可用于电解制Al,其反应的化学方程式是______________________。
(2)调控反应池中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3溶于NaOH的离子方程式是_________________。
(3)该生产过程中,需向沉淀池中加入X。
① X 可为过量的CO2,则滤液II中主要的溶质是____________,为了使滤液II循环利用,应补充的物质是____________(选填字母);
a.CaO b.HCl c.Na2CO3
② X 也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com