
综合下图判断,下列叙述不正确的是
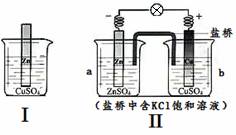
A. Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO3和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
在等温等压条件下,可逆反应2A(g)+B(g)3C(g)+D(g)起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
上述反应达到平衡后,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )

A.甲容器中A的反应速率为0.1 mol·L-1·min-1
B.给甲容器加压可缩短反应达到平衡的时间
C.给乙容器升温可缩短反应达到平衡的时间
D.甲和乙中A的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3OH(g)CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。在此温度下,向密闭容器中加入一定量CH3OH,反应到5 min时测得各组分的浓度如表所示:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
(1)该反应在低温下(此时水为液态)能自发进行,则该反应的ΔH______0(填“>”、“<”或“=”,下同)。
(2)比较此时正、逆反应速率的大小:v正______v逆。
(3)前5 min时,用CH3OCH3表示该反应的速率为________________。
(4)再过一段时间后,反应达到平衡状态。能判断该反应已达到化学平衡状态的依据是__________(填字母)。
A.容器中压强不变
B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O)
D.c(CH3OCH3)=c(H2O)
(5)达到平衡状态时,CH3OH的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子数之和是O原子数的5倍。
(1)A的分子式是________________。已知:各有机物间存在如下转化关系
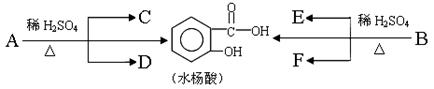 |
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类型的有机物。
(2)水杨酸中所含官能团的名称是____________;完全燃烧时,1 mol D与1 mol 下列有机物耗氧量相同的是____________(填字母代号)。
a. C3H6O3 b. C3H8O c. C2H4 d. C2H6O2
(3)B的结构简式是________________________;
水杨酸与小苏打溶液反应的化学方程式:_________________________________; 一定条件下,C与F反应的反应类型是____________。
(4)写出C与足量银氨溶液的反应化学方程式:________________________________;反应类型是____________。
(5)同时符合下列要求的化合物有____________种。
① 与A互为同分异构体 ② 可以水解
③ 苯环上有两个取代基,且苯环上的一氯代物只有1种
(6)1 mol上述(5)中的一种有机物X 在水溶液中,能与4 mol NaOH共热发生反应,写出此反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是 ( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好
C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
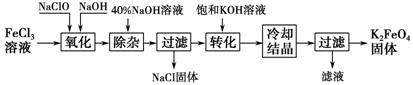
(1)完成“氧化”过程中反应的化学方程式:
FeCl3+____NaOH+____NaClO→____Na2FeO4+____+____。其中氧化剂是____(填化学式)。
(2)“转化”过程中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO,该电极反应方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com