
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
分析 A.在水处理过程中高铁酸钾被还原为Fe3+,铁离子水解生成氢氧化铁胶体;明矾中铝离子水解生成氢氧化铝胶体而净水;
B.煤的气化是使煤在氧气、水蒸气存在的情况下发生化学反应;
C.维生素C具有还原性,可防止亚铁被氧化;
D.器在空气中久置变黑是因为Ag和硫化氢发生化学反应.
解答 解:A.高铁酸钾具有强氧化性,能杀菌消毒,且在水处理过程中高铁酸钾被还原为Fe3+,铁离子水解生成氢氧化铁胶体,然后用氢氧化铁胶体净水;明矾中铝离子水解生成氢氧化铝胶体而净水,所以二者处理水原理不同,故A错误;
B.煤的气化是使煤在氧气、水蒸气存在的情况下发生化学反应,从而转化为既可作燃料气,又可作化工原料的一氧化碳、氢气、甲烷等气体,有新物质生成,属于化学变化,故B错误;
C.维生素C具有还原性,可防止亚铁被氧化而失效,所以可在口服硫酸亚铁片时同服维生素C,来增强治疗缺铁性贫血效果,故C正确;
D.器在空气中久置变黑是因为Ag和硫化氢发生化学反应,属于化学腐蚀,故D错误;
故选C.
点评 本题考查元素化合物性质,为高频考点,涉及氧化还原反应、化学腐蚀、煤的综合利用、净水等知识点,明确物质性质、反应原理是解本题关键,注意煤的气化和液化都属于化学变化.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
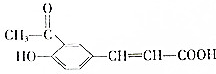
| A. | 1mol该有机物最多可与6mol H2发生加成反应 | |
| B. | 该有机物可发生水解反应、取代反应和氧化反应 | |
| C. | 加入碳酸氢钠溶液,产生气泡,说明含有羧基 | |
| D. | 加入溴水,溴水褪色,说明含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子结构示意图: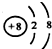 可以表示16O2-,也可以表示18O2- 可以表示16O2-,也可以表示18O2- | |
| B. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 氯化铵的电子式为: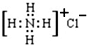 | |
| D. | 二氧化碳分子的比例模型是: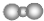 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
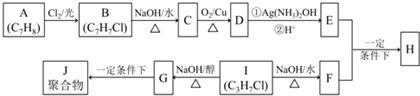
 .
. .②I→G 的化学方程式
.②I→G 的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com