
【题目】人们生活中使用的化纤地毯、三合板、油漆等化工产品,会释放出某种污染空气的气体,该气体是
A. 甲醛 B. 二氧化硫 C. 甲烷 D. 乙醇
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。
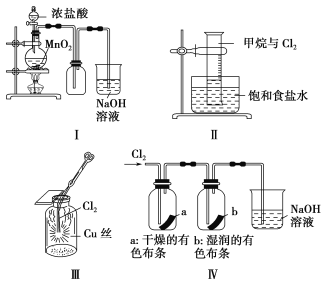
下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式__________________________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:
2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
① 根据上述实验结果,该反应的平衡常数K的计算式为:___________。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. ②中选用品红溶液验证SO2的生成
B. ③中选用NaOH溶液吸收多余的SO2
C. 为确认有CuSO4生成,向①中加水,观察颜色
D. 上下移动①中铜丝可控制SO2的产生与停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述中错误的是( )
A.当光束通过下列分散系:有尘埃的空气、豆浆、墨水都能观察到丁达尔效应
B.溶液、胶体、浊液的根本区别是分散质微粒直径的大小
C.把1mL0.1mol/L三氯化铁溶液滴加入20mL沸水中,边加边振荡,可制得氢氧化铁胶体
D.胶体的稳定性介于溶液和浊液之间,属于介稳体系
X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________(用离子方程式说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2 溶液中 c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中 c(NH4+)。
(3)均为 0.1 mol·L-1 的几种电解质溶液的pH 随温度变化的曲线如下图1所示。
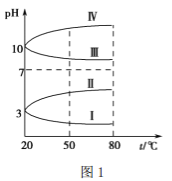
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填罗马数字),导致 NH4Al(SO4)2溶液的pH 随温度变化的原因是_____________________;
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中 2c(SO42-)-c(NH4+)-3c(Al3+)=____________ mol·L-1。
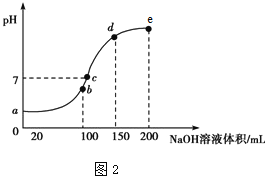
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如上图2所示。
试分析图中 a、b、c、d四个点,水的电离程度最大的是___________点,在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,我国重点城市空气质量日报的监测项目中不包括
A.二氧化硫(SO2) B.二氧化碳(CO2)
C.二氧化氮(NO2) D.总悬浮颗粒物(TSP)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com