
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )| A. | BC段为Fe3+的变化曲线 | |
| B. | 原混合溶液中FeBr2的物质的量为6mol | |
| C. | 当通入2mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
分析 2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,还原性为Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,还原性为I->Fe2+,所以还原性I->Fe2+>Br-,则向FeI2、FeBr2的混合溶液中通入适量氯气,AB段发生2I-+Cl2=I2+2Cl-,BC段发生2Fe2++Cl2=2Fe3++2Cl-,最后发生2Br-+Cl2=Br2+2Cl-,以此来解答.
解答 解:A.BC段发生2Fe2++Cl2=2Fe3++2Cl-,则BC段为Fe3+的变化曲线,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握还原性的强弱及反应的先后顺序、反应与图象的对应关系为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 2CH2CH2OH$→_{△}^{Cu}$2CH3CHO+H2O | ||
| C. | CH4+Cl2$\stackrel{光}{→}$CH2Cl+HCl | D. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2和PCl5 | B. | HClO和SO2 | C. | P4和COS(羰基硫) | D. | SiO2和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
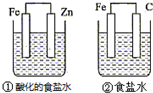
| A. | ①和②中铁的腐蚀均被加速 | |
| B. | ①和②中负极反应均是Fe-2e-═Fe2+ | |
| C. | ②中碳棒上反应是O2+2H2O+4e-═4OH- | |
| D. | ①装置中溶液pH会升高,②装置中溶液碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com