
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
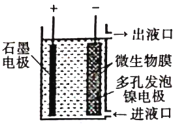
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
【答案】A
【解析】
A、阴极上发生的电极反应式为:2NO3-+6H2O+10e-=N2+12OH-;
B、镍电极是阴极,是硝酸根离子得电子;
C、电子流入石墨电极,且电子不能经过溶液;
D、由电极反应2NO3-+6H2O+10e-=N2+12OH-,生成1mol氮气消耗2mol的硝酸根离子。
A项、阴极上发生的电极反应式为:2NO3-+6H2O+10e-=N2+12OH-,所以导出的溶液呈碱性,故A正确;
B项、镍电极是阴极,是硝酸根离子得电子,而不是镍发生氧化反应,故B错误;
C项、电子流入石墨电极,且电子不能经过溶液,故C错误;
D项、由电极反应2NO3-+6H2O+10e-=N2+12OH-,生成1mol氮气消耗2mol的硝酸根离子,所以若阳极生成0.1mol气体,理论上可除去0.2 molNO3-,故D错误。
故选A。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1)复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2)硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
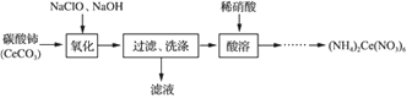
①“氧化”得到CeO2的化学方程式为______________。
②洗涤CeO2的方法是_____________。
(3)为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:
①称取样品2.4480g,加水溶解后配成100.00mL溶液A;
②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成NH30.06720L(标准状况);
③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O40.2290g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO![]() +2H2O
+2H2O
B.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+
+4H+
C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O![]() +6H+=2S↓+3H2O
+6H+=2S↓+3H2O
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是( )
A.元素的金属性:K>Rb
B.中子数为50的Rb的核素:![]() Rb
Rb
C.与同周期元素53I的原子半径比:Rb<I
D.最高价氧化物对应的水化物的碱性:KOH<RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛应用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:
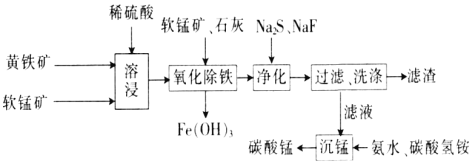
已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度
C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、SO42-,请写出主要反应的离子方程式:___________;浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿目的是______________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
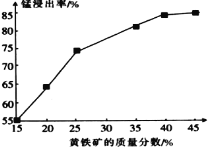
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2![]() +O2+4OH-===Fe3O4+
+O2+4OH-===Fe3O4+![]() +2H2O。下列说法正确的是()
+2H2O。下列说法正确的是()
A.O2和![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1mol![]() 转移2mol电子
转移2mol电子
D.每2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DL—m—络氨酸是一种营养增补剂,能提高人体的免疫力。一种合成DL—m一络氨酸的路线如下:
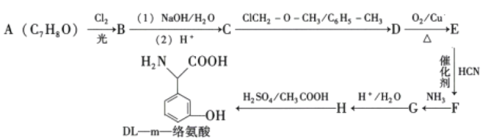
已知:①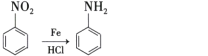
②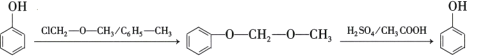
③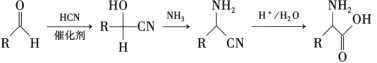
回答下列问题:
(1)A的化学名称为 ________,F中含氧官能团的名称是________。
(2)E到F的反应类型为________。
(3)写出D到E的化学方程式________。
(4)化合物M是一种α-氨基酸,是H的同分异构体。满足以下条件的M的同分异构体有________种。
i.环上有两个处于邻位上的取代基,与FeCl3溶液不能发生显色反应;
ii.1molM与足量金属钠反应产生1.5molH2。
其中分子中存在两个手性碳原子,且能在浓硫酸催化加热条件下发生消去反应而消除旋光性,该异构体的结构简式为________、________(已知:分子中存在手性碳原子的分子叫手性分子,手性分子具有旋光性)。
(5)![]() 是合成药物扑热息疼的中间体。设计由苯酚和ClCH2—O—CH3制备
是合成药物扑热息疼的中间体。设计由苯酚和ClCH2—O—CH3制备![]() 的合成路线________(无机试剂任选。)
的合成路线________(无机试剂任选。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
(1)①某原电池装置如图所示,右侧烧杯中的电极反应式为__,左侧烧杯中的c(Cl-)__(填“增大”、“减小”或“不变”)。
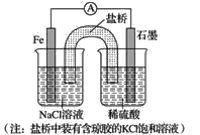
②已知如图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料_____(填“Fe”或“C”)。
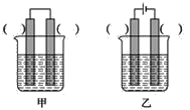
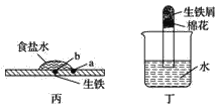
(2)装置丙中,易生锈的是__(填“a”或“b”)点。装置丁中可观察到的实验现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据《化学反应原理》中相关知识,按要求作答。
氯的单质、化合物与人类生产、生活和科研密切相关。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+Cl2(g)=2HCl(g)△H = -184.6 kJ . mol-1,判断该反应属于_____(填“吸热”或“放热")反应。
(2)盐酸是一种强酸,补充完整电离方程式:HCl=___+Cl- 。室温下,将大小相等的镁条和铁片投入同浓度的稀盐酸中,产生氢气的速率较大的是________。
(3)84消毒液在防控新冠肺炎疫情中被大量使用,它是利用氯气与氢氧化钠溶液反应制成的.反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
①该反应____(填“是”或“不是”)氧化还原反应。
②室温下,84消毒液呈碱性,其pH___7 (填“>”或“<”)。
③84消毒液的有效成分NaClO,水解的离子方程式:ClO-+H2O=HClO+OH-,生成物中__具有很强的氧化性,可以使病毒和细菌失去生理活性;水解是吸热反应,升高温度平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)电解熔融氯化钠可制取金属钠和氯气,装置如图所示(电极不参与反应):
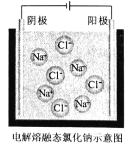
通电时,Na+向______(填“阳极”或“阴极")移动,写出生成金属钠的电极反应式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com