
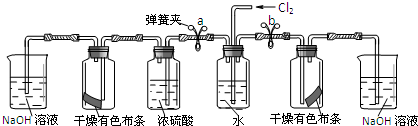
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
分析 (1)氯气和水反应生成盐酸和次氯酸,反应中元素化合价升高失电子被氧化得到氧化产物次氯酸;
(2)Ⅰ.①猜测一:氯气具有漂白性,能使有色布条褪色,验证此结论不正确,需要得到干燥的氯气通过干燥的有色布条来验证;
②猜测二:氯气与湿润有色布条上的水分作用,产生的次氯酸使有色布条褪色,验证此结论需要氯气中含水蒸气,通过干燥的有色布条观察褪色情况;
Ⅱ.氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收.
解答 解:(1)氯气和水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,反应中氯元素化合价0价变化为-1价和+1价,氧化产物为HClO,
故答案为:Cl2+H2O=H++Cl-+HClO; HClO;
(2)I.①松开a处弹簧夹,夹上b处弹簧夹,通入氯气经过水除去氯化氢,通过左侧浓硫酸干燥得到干燥氯气通过干燥有色布条,布条不褪色证明猜想一不正确,
故答案为:夹上; 不褪色;
②松开b处弹簧夹,夹上a处弹簧夹,通入氯气,通过水得到氯气含水蒸气,进入呈干燥有色布条的广口瓶,布条褪色证明猜想二正确,
故答案为:b处弹簧夹,夹上a处弹簧夹; 正确;
Ⅱ.该装置左右两边均设计了盛有氢氧化钠溶液的吸收装置,作用是:吸收多余的尾气,以免氯气污染空气,
故答案为:吸收多余的尾气,以免氯气污染空气.
点评 本题考查了氯气性质、氯气漂白性的实验验证,注意装置作用恒容实验过程的分析判断,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
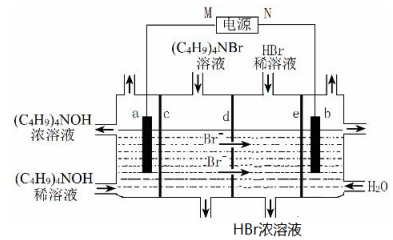
| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
| A. | 在0~20 min内,Ⅰ中M的分解速率为0.015 mol•L-1•min-1 | |
| B. | 水样酸性越强,M的分解速率越快 | |
| C. | 在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大 | |
| D. | 由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
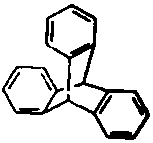
| A. | 三蝶烯是苯的同系物 | |
| B. | 三蝶烯能发生取代反应 | |
| C. | 三蝶烯的一氯代物有6种 | |
| D. | 三蝶烯分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
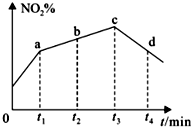 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可以提高该反应的焓变 | |
| B. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| C. | 反应450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com