
| A、在一定温度下,AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B、催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C、应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D、由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
| 加热 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾--淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、将SO2通入Ba(NO3)2溶液,有白色沉淀生成,证明BaSO3难溶于硝酸 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
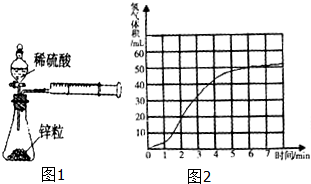 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 | ||
| ① | 单位时间内Zn2+物质的量浓度的增加量 | v(Zn2+)=
| mol/(L?min) | ||
| ② |
| 编号 | 锌的形状 | 锌的规格 | 硫酸的浓度 | 反应温度 | 实验设计的目的 |
| ① | 块状 | 纯锌 | 1mol/L | 25℃ | Ⅰ.实验①和②研究 Ⅱ.实验②和③研究 Ⅲ.实验③和④研究 Ⅳ.实验④和⑤研究 |
| ② | 颗粒状 | 纯锌 | 1mol/L | 25℃ | |
| ③ | 颗粒状 | 纯锌 | 25℃ | ||
| ④ | 颗粒状 | 2mol/L | 25℃ | ||
| ⑤ | 颗粒状 | 粗锌 | 2mol/L | 35℃ | |
| … | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
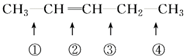 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )| A、①④ | B、①③ | C、② | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com