
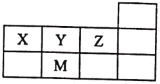
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
【答案】D
【解析】
由X、Y、Z、M均为短周期元素及在周期表中相对位置,可知X、Y和Z为第二周期元素, M为第三周期元素,由位置可知,X为N,Y为O,Z为F,M为S,以此来解答。
A. 电子层数越多,其原子半径越大;电子层数相同时,原子序数越小,其原子半径越大;
B. 非金属性越强,其气态氢化物的稳定性越好,这与是否含有氢键无关;
C. F元素无最高正价;
D. 在元素周期表中同一周期,元素的非金属性依次增强,同一主族,元素的非金属性依次减弱;
由上述分析可知,X为N,Y为O,Z为F,M为S,
A. 根据同一周期中,原子半径依次减小,同一主族,元素原子半径依次增大,则其原子半径由大到小排列为:M >X >Y >Z,故A项错误;
B. 元素的非金属性越强,其对应的气态氢化物的稳定性越高,则Z的气态氢化物最稳定,其分子间存在的氢键,主要影响的是物质的物理性质,跟气态氢化物的稳定性无关,故B项错误;
C. 非金属性F>O>S,但因F无正价,则无法比较Z与M的最高价氧化物对应水化物的酸性,故C项错误;
D. X、Y、Z三种元素处于同一周期,其元素的非金属性:N<O<F,即X<Y<Z,故D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
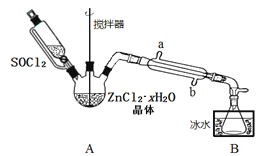
①SOCl2在该实验中的作用_________________________________;加热条件下,A装置中总的化学方程式为_________________________________。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________(保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若无明显现象 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器内,充入一定量的NO和O2,800°C时发生反应2NO(g)+O2(g)![]() 2NO2(g),容器中n(NO)随时间的变化如表所示:
2NO2(g),容器中n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1~2s内,O2的物质的量减少__mol。该反应在第3s___(填“达到”或“未达到”)平衡状态。
(2)如图所示,表示NO2浓度变化曲线的是___(填字母)。用O2表示0~2s内该反应的平均速率v=___mol·L-1·s-1。

(3)能说明该反应已达到平衡状态的是___(填字母)。
a.容器内气体颜色不再变化
b.O2的物质的量保持不变
c.容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C原子核内质子数之和为31,最外层电子数之和为17,这三种元素是()
A. N、P、ClB. P、O、SC. O、F、ClD. N、O、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2![]() 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
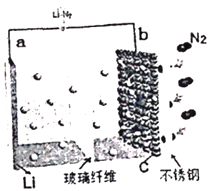
A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。有关该反应的说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。有关该反应的说法正确的是( )
A. H2C2O4是还原剂B. KClO3在反应中失电子
C. KClO3被还原D. H2SO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H的含义表示正确的是
A. H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H(中和热)
B. NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l) △H(中和热)
Na2SO4(aq)+H2O(l) △H(中和热)
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H(燃烧热)
D. 2H2(g)+O2(g)=2H2O(g) △H(燃烧热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com