
分析 (1)根据烃A分子中碳的质量分数,计算分子中C原子、H原子数目,写出A的分子式;由于A、B的最简式相同,再结合烃B式量比空气的平均式量稍小,推断B的分子式;
(2)烃A、B都能使溴的四氯化碳溶液褪色,含有不饱和键,根据A、B的分子式与结构判断是否存在同分异构体,根据结构及分子式书写限制条件的同分异构体;
(3)烃B能使溴的四氯化碳溶液褪色,说明B含不饱和键,结合分子式判断其结构,写出方程式;
(4)实验室制备乙烯是利用乙醇在浓硫酸催化作用发生消去反应生成;
解答 解:(1)由于碳元素的质量分数为85.7%,所以烃A中C原子的数目为$\frac{56×85.7%}{12}$=4,所以烃A中H原子的数目为$\frac{56-12×4}{1}$=8,所以烃A的分子式为C4H8;
A、B的最简式相同,最简式为CH2,B式量比空气的平均式量稍小,最简式CH2,所以B的分子式为C2H4,
故答案为:C4H8;C2H4;
(2)A为C4H8,B为C2H4,二者都能使溴的四氯化碳溶液褪色,说明分子中含有1个C=C双键,属于烯烃.
A存在同分异构体,有:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2;B不存在同分异构体,
故答案为:A;CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2;
(3)B的分子式为C2H4,能使溴的四氯化碳溶液褪色,则B为乙烯CH2=CH2.与乙烯反应的方程式为:
CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(4)实验室制备乙烯是利用乙醇在浓硫酸催化作用发生消去反应生成,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
点评 本题考查有机物分子式推断、限制条件同分异构体书写、烯烃的性质等,题目难度中等,注意根据C的质量分数进行推断.


科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
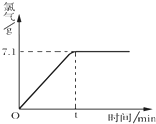 氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com