
【题目】下列说法中正确的是
A.石油分馏、煤的干馏都是物理变化
B.![]() 和
和![]() 为同一种物质
为同一种物质
C.油脂的“皂化”即为油脂的“硬化”
D.糖类、油脂和蛋白质均是天然高分子化合物
【答案】B
【解析】
A.石油分馏是分离互溶的沸点不同的液体混合物,由于没有新物质产生,所以发生的是物理变化;而煤的干馏则是将煤隔绝空气加强热使之分解的过程,由于产生了新的物质,因此发生的变化是化学变化,A错误;
B.甲烷是正四面体结构,分子中任何2个H原子都相邻,![]() 和
和![]() 可看作是甲烷分子中的3个H原子分别被1个F原子、2个Cl原子取代产生的物质,因此是同一种物质,B正确;
可看作是甲烷分子中的3个H原子分别被1个F原子、2个Cl原子取代产生的物质,因此是同一种物质,B正确;
C.油脂的“氢化”即为油脂的“硬化”,而油脂的“皂化”即为油脂在碱性条件下水解产生高级脂肪酸盐的反应,C错误;
D.糖类中的单糖、低聚糖和油脂不属于高分子化合物,而淀粉、纤维素及蛋白质是天然高分子化合物,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,是难溶于水的白色固体,能溶解于硝酸,在潮湿空气中可被迅速氧化。
Ⅰ.实验室用CuSO4—NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如图:
图甲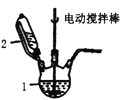 图乙
图乙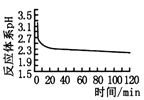 图丙
图丙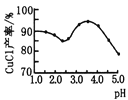
回答以下问题:
(1)甲图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_____________。
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式_____________。丙图是产率随pH变化关系图,实验过程中往往用Na2SO3—Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是_______并维持pH在______左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是________。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
A.  CuCl的盐酸溶液 B.
CuCl的盐酸溶液 B.  Na2S2O4和KOH的混合溶液
Na2S2O4和KOH的混合溶液
C.  KOH溶液 D.
KOH溶液 D. 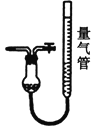
已知:Na2S2O4和KOH的混合溶液可吸收氧气。
(4)装置A中用盐酸而不能用硝酸,其原因是__________(用化学方程式表示)。用D装置测N2含量,读数时应注意________。整套实验装置的连接顺序应为_______________→D。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
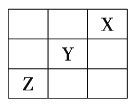
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验: 上面对照实验不能完成实验目的的是

A.![]() 、
、![]() 对照,比较
对照,比较![]() 、
、![]() 中羟基氢原子的活泼性
中羟基氢原子的活泼性
B.![]() 、
、![]() 对照,说明
对照,说明![]() 中存在不同于烃分子中的氢原子
中存在不同于烃分子中的氢原子
C.![]() 、
、![]() 对照,能说明苯环对羟基的化学性质产生影响
对照,能说明苯环对羟基的化学性质产生影响
D.![]() 和
和![]() 、
、![]() 和
和![]() 对照,说明官能团对有机物的化学性质起决定作用
对照,说明官能团对有机物的化学性质起决定作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2、碳酸盐、有机物等均是自然界碳循环中的重要物质。回答下列问题:
(1)下列物质属于化合物但不属于电解质的是______(填字母)。
A.石墨 B.汽油 C.乙醇 D.碳酸
(2)倍半碳酸钠(Na2CO3·NaHCO3·2H2O)在水溶液中的电离方程式为__________________________。
(3)金属钠在足量CO2中燃烧生成常见的盐和单质,写出反应的化学方程式:____________。
(4)铜器表面的难溶物Cu2(OH)2CO3可用稀硫酸洗涤除去,该反应的离子方程式为________________。
(5)工业上制取金刚砂的反应为: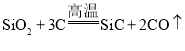 ,该反应中氧化剂与还原剂的物质的量之比为______。
,该反应中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:
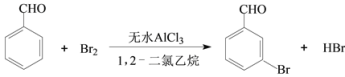
已知:(1)间溴苯甲醛温度过高时易被氧化。
(2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表:
物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 |
沸点/℃ | 58.8 | 179 | 83.5 | 229 |
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。

步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤出
MgSO4nH2O晶体。
步骤4:减压蒸馏有机层,收集相应馏分。
(1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。
(2)步骤1反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。
A.>229℃ B.58.8℃~179℃ C.<58.8℃
(3)步骤2中用10% NaHCO3溶液洗涤,是为了除去溶于有机层的___(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_____。
(5)步骤4中采用减压蒸馏,是为了防止______。
(6)若实验中加入了5.3 g苯甲醛,得到3.7 g间溴苯甲醛。则间溴苯甲醛产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。
实验一:通过质谱分析仪分析得知有机物A的相对分子质量为90。
实验二:用红外光谱分析发现有机物A中含有—COOH和 —OH。
实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O。
实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1。
(1)有机物A的结构简式为_______。
(2)有机物A在一定条件下可以发生的反应有_______。
a.消去反应 b.取代反应 c.聚合反应 d.加成反应 e.氧化反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为C3H4O2,B能和溴发生加成反应,则B的结构简式为_______。另一种产物C是一种六元环状酯,写出生成C的化学方程式:_______。
(4)写出A与足量的金属钠反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
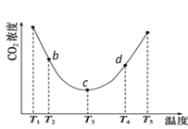
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A、υ(A)=0.5mol/(L·min) B、υ(B)=1.2mol/(L·s)
C、υ(C)=0.1mol/(L·s) D、υ(D)=0.4mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com