
元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。
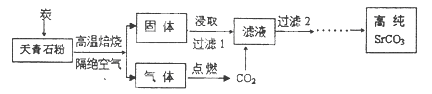
(1)写出与元素锶同族第3周期元素的原子结构示意图: 。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式: 。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是 (用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是 。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为:
 SrSO4(s)+CO
SrSO4(s)+CO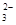 (aq)
SrCO3(s)+SO
(aq)
SrCO3(s)+SO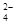 (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K= 。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是 (写一种)。
(14分)(1)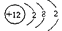 (2分)
(2分)
(2)SrSO4+4C SrS+4CO↑(3分)
SrS+4CO↑(3分)
(3)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH—(3分)
HOCH2CH2NH3++OH—(3分)
(4)洗涤、烘干(2分)
(5)3×103(2分)
(6)还含有天青石中原有的不溶性杂质(或SrSO4(s)+CO32—(aq) SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4)(2分)
SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4)(2分)
【解析】
试题分析:(1)第3周期第IIA族元素为镁,核电荷数为+12,核外电子层结构为282;(2)根据题意可知,硫元素的化合价由+6降为—2,根据电子、原子守恒可知,该反应式为SrSO4+4C SrS+4CO↑;(3)NH3+H2O
SrS+4CO↑;(3)NH3+H2O NH3•H2O
NH3•H2O NH4++OH—,由相似性可知,HOCH2CH2NH2+H2O
NH4++OH—,由相似性可知,HOCH2CH2NH2+H2O HOCH2CH2NH3++OH—;(4)过滤之后,需要洗涤沉淀,除去沉淀表面吸附的可溶物,然后再干燥,除去水分;(5)根据题意,K=
HOCH2CH2NH3++OH—;(4)过滤之后,需要洗涤沉淀,除去沉淀表面吸附的可溶物,然后再干燥,除去水分;(5)根据题意,K=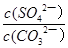 =
=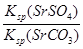 =
=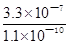 =3×103;(6)SrSO4(s)+CO32—(aq)
=3×103;(6)SrSO4(s)+CO32—(aq) SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4等不溶性杂质。
SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4等不溶性杂质。
考点:考查物质结构和元素周期表、氧化还原反应、离子方程式、混合物的分离和提纯、溶度积和化学平衡常数的计算、沉淀的转化等相关知识。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011年高考化学一轮复习:《化学键与化学反应》(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com