
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
分析 由放电时的电极反应式:Cd+2OH--2e-═Cd(OH)2,2NiOOH+2H2O+2e-═2Ni(OH)2+2OH-,两极反应相加得到总反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2,放电时阴离子向负极移动,充电时阴极与负极相连,正极与阳极相连,根据充放电时的两电极反应来解答.
解答 解:A、由放电时的电极反应式:Cd+2OH--2e-═Cd(OH)2,2NiOOH+2H2O+2e-═2Ni(OH)2+2OH-,两极反应相加得到总反应为:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2,故A正确;
B、电池充电时,镉元素的化合价降低,在反应中被还原,故B正确;
C、电池放电时,电池负极电极反应式:Cd+2OH--2e-═Cd(OH)2,消耗氢氧根离子,所以负极周围溶液的pH不断减小,故C错误;
D、电池充电时,电池的负极和电源的负极相连,故D错误.
故选CD.
点评 本题考查电极反应式的书写,明确电极上得失电子及反应物质是解本题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚四氟乙烯的化学活动性很强 | B. | 聚四氟乙烯分子中含有双键 | ||
| C. | 聚四氟乙烯的单体是不饱和烃 | D. | 聚四氟乙烯中氟的质量分数是76% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
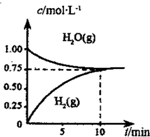 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=$\frac{0.10}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处在同一直线上 | |
| B. | 它的五氯代物数目与三氯代物的数目相等 | |
| C. | 它属于烃类 | |
| D. | 该物质易溶于水,难溶于有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com