
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是

A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
【答案】B
【解析】
根据装置图和电解总反应分析,Cu极为阳极,Cu极电极反应式为2Cu-2e-+2OH-=Cu2O+H2O;Ti极为阴极,Ti极电极反应式为2H2O+2e-=H2↑+2OH-;电解池中阴离子通过阴离子交换膜向阳极移动;据此分析作答。
Cu极与外加电源的正极相连,Cu极为阳极,Ti极与外加电源的负极相连,Ti极为阴极;
A项,电解时阴离子向阳极移动,OH-通过阴离子交换膜向Cu极移动,A项错误;
B项,Cu极为阳极,阳极电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,B项正确;
C项,Ti极为阴极,阴极电极反应式为2H2O+2e-=H2↑+2OH-,阴极有H2生成,C项错误;
D项,根据电极反应式和阴、阳极得失电子相等,Ti极生成的H2和Cu极生成的Cu2O物质的量之比为1:1,D项错误;
答案选B。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为: N2(g)+3H2(g)![]() 2NH3(g) ΔH= - 92.4 kJ·mol-1.
2NH3(g) ΔH= - 92.4 kJ·mol-1.
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ(填“小于”,“大于”或“等于”)。
(2)当反应达到平衡时,N2和H2的浓度比是_________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
II.该反应在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1时刻,体系中发生变化的条件是_______ 。
A.增大压强B.升高温度C.减小压强D.降低温度 E.加入正催化剂
(2)下列时间段中,氨的百分含量最高的是_______。
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. (NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 ![]() 2NH4+ + Fe2 + + 2SO42-
2NH4+ + Fe2 + + 2SO42-
B. Al(OH)3在水中的电离:Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C. H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D. NaHSO3在水中的电离:HSO3- + H3O+![]() SO32-+ H2O
SO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
①25℃时,0.175 mol/L的H3BO3溶液pH约为_________。
②已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 4.7×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
①体系中H2的物质的量与反应时间的关系如表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
②图为产率与反应温度的关系曲线,NaBH4的产率在603K之前随温度升高而增大,在603K之后随温度升高而减小的原因是_________。

(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。

①通常状况下,实验测得3.8 g NaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
②![]() 为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg![]() 随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。写出电镀阳极反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是_____

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
(3)①室温下,在0.5mol/L纯碱溶液中加入少量水,由水电离出的c(H+)×c(OH-)_________。(填“变大”、“变小”、“不变”)
②已知Ksp(Ag2CrO4)=1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.00008mol/LK2CrO4溶液,则溶液中的c(CrO42-)=___________。
③室温下,0.1mol/LNaHCO3溶液的pH值______0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e—=Na2S+Fe,则该电池在充电时,阳极发生反应的物质是____________,放电时负极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如图: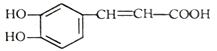 ,下列说法不正确的是
,下列说法不正确的是
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol咖啡酸最多能与4molH2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A的分子式为C8H12O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l);ΔH=-285.8kJ·mol-1
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g);ΔH=+283.0 kJ/mol
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是

A. 溶液中H+的物质的量
B. 溶液的导电能力
C. 溶液中的c(CH3COO-)/c(CH3COOH)
D. CH3COOH的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com