
判断正误,正确的划“√”,错误的划“×”
(1)测定NaOH溶液浓度,可用滴定管、锥形瓶、烧杯、NaOH溶液、0.100 0 mol·L-1盐酸达到目的( )
(2014·安徽理综,9D)
(2)用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低( )
(2014·大纲全国卷,6D)
(3) ( )
( )
(2014·山东理综,10B)
(4)50 ℃时,pH=4的醋酸中,c(H+)=4.0 mol·L-1( )
(2013·广东理综,12A)
(5)50 ℃时,pH=12的纯碱溶液中,c(OH-)=1.0×10-2 mol·L-1( )
(2013·广东理综,12C)
(6)在蒸馏水中滴加浓硫酸,Kw不变( )
(2013·天津理综,5A)
(7)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
(2013·天津理综,5D)
(8)25 ℃与60 ℃时,水的pH相等( )
(2012·福建理综,10B)
(9)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
(10)用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和( )
(2012·浙江理综,12C)
(11)常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4( )
(2012·浙江理综,12A)
(12)“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用( )
(2011·浙江理综,8C)
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
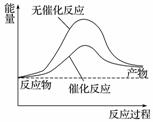
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: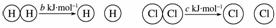
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为 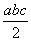 kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
求下列常温条件下溶液的pH(已知lg1.3=0.1,lg2=0.3,混合溶液忽略体积的变化)。
(1)0.005 mol·L-1的H2SO4溶液
(2)0.1 mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度= ×100%)
×100%)
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合
(6)将pH=3的HCl与pH=3的H2SO4等体积混合
(7)0.001 mol·L-1的NaOH溶液
(8)pH=2的盐酸与等体积的水混合
(9)pH=2的盐酸加水稀释到1 000倍
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
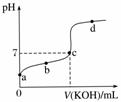
(1)a点溶液中c(H+)为________,pH约为________。
(2)a、b、c、d四点中水的电离程度最大的是________,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
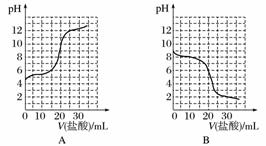

查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.335 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”、“偏低”或“不变”)。
(2)氨气常用________检验,现象是______________________________________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol·L-1某碱AOH溶液的pH=11,将该溶液稀释10倍后,溶液的pH不可能为( )
①10.1 ②10.8 ③12 ④11.5
A.③④ B.①②
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com