
分析 反应中只有Cl元素化合价发生变化,KClO3中氯元素的化合价由+5价变为0价,HCl中Cl元素化合价由-1价升高到0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:1)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,1KClO3中氯元素的化合价由+5价变为0价,所以1KClO3是氧化剂,5HCl中Cl元素化合价由-1价升高到0价,所以5HCl是还原剂,则氧化剂与还原剂的物质的量之比是1:5;故答案为:1:5;
2)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,6HCl参与反应,其中5HCl中Cl元素化合价由-1价升高到0价,1HCl化合价不变,所以盐酸体现出的性质有酸性和还原性,故答案为:酸性和还原性;
3)反应中只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
故答案为: ;
;
4)当被氧化的HCl为73克时即$\frac{73g}{36.5g/mol}$=2mol,又HCl中Cl元素化合价由-1价升高到0价被氧化,所以转移2mol电子,数目为1.204×1024,故答案为:1.204×1024.
点评 本题考查氧化还原反应,为高频考点,根据反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
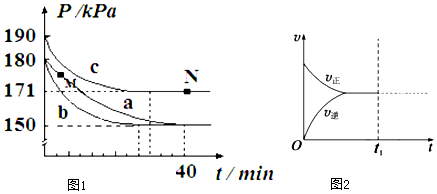
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45mol/L | B. | 0.5mol/L | C. | 0.6mol/L | D. | 0.55mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
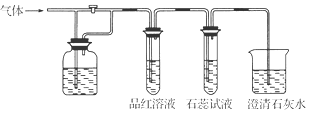
| A. | H2S和浓H2SO4 | B. | SO2和NaHCO3溶液 | C. | Cl2和NaHCO3溶液 | D. | Cl2和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业中,增大O2的浓度有利于提高SO2的转化率 | |
| B. | 开启啤酒瓶后,瓶中立刻泛起大量泡 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| D. | 滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13:8 | B. | 8:13 | C. | 16:9 | D. | 9:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
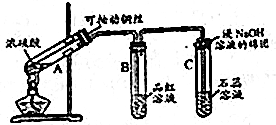
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
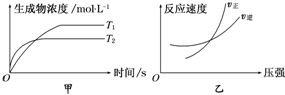
| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com