
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 盐酸跟过量的铁粉反应时,盐酸完全反应,为了减缓反应速率,且不影响生成氢气的总量,则可减小氢离子的浓度,但不能改变其物质的量,以此来解答.
解答 解:①NaOH(固体)与盐酸反应,生成氢气减少,故不选;
②NaCl溶液与盐酸不反应,氢离子浓度减小、但物质的量不变,则可减缓反应速率,且不影响生成氢气的总量,故选;
③加HCl时,氢离子浓度及物质的量均增大,生成氢气增加、速率加快,故不选;
④CH3COONa(固体)与盐酸反应生成醋酸,醋酸为弱酸,减小氢离子的浓度,但不能改变其物质的量,则可减缓反应速率,且不影响生成氢气的总量,故选;
故选D.
点评 本题考查反应速率的影响因素,为高频考点,把握浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大,注意盐酸完全反应.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去油污效果比冷的纯碱溶液去油污效果好 | |
| B. | 加热稀醋酸溶液其pH 稍有减小 | |
| C. | 实验室制FeCl3溶液时,把FeCl3固体溶于浓盐酸中,再加水稀释到所需的浓度 | |
| D. | 草木灰与铵态氮肥不能混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均不能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀NHO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
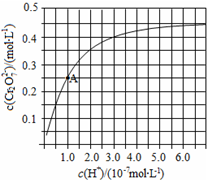 铬是用途广泛的金属元素.
铬是用途广泛的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种共价键 | |
| B. | 由分子组成的物质中都含有氢键 | |
| C. | HF的沸点高于HCl是由于HF分子间存在氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y 分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X 的最高价氧化物对应的水化物的酸性比W 的弱 | |
| D. | Y 的气态简单氢化物的热稳定性比W 的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com