
| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |
分析 A、金属的腐蚀与防护中如果有外接电源,此方法为外加电源的阴极保护法;
B、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅;
C、CaCO3的溶解度小于CaSO4,根据沉淀的转化来分析;
D、根据影响化学平衡移动的因素来回答.
解答 解:A、将钢闸门与外加电源负极相连,阴极上电解质溶液中阳离子得电子发生还原反应,此方法为外加电源的阴极保护法,可防止钢闸门腐蚀,故A正确;
B、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量增加,故B错误;
C、CaCO3的溶解度小于CaSO4,故CaSO4用饱和Na2CO3溶液浸泡可转化为溶解度更小的CaCO3,然后再用稀盐酸溶解除去,故C正确;
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值不变但是氧气会和NO反应,化学平衡正向移动,所以SO2转化率增大,故D错误.
故选AC.
点评 本题综合考查电化学金属的腐蚀和防护以及化学平衡移动原理知识,属于综合知识的考查,难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
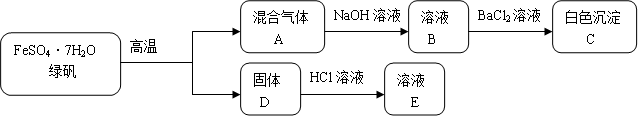
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)?2SO3(g);△H=-2a KJ/mol | B. | 2SO2(g)+O2(g)2?SO3(g);△H=-a KJ/mol | ||
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=a KJ/mol | D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-2a KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Z)>r(Y)>r(M) | |
| B. | Y和M形成的化合物只含有离子键 | |
| C. | 元素非金属性由弱到强的顺序:M、N、X | |
| D. | 电解N和Z形成的化合物可得到Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
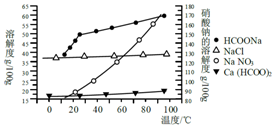 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4Cl溶液是电解质 | |
| B. | Al2O3是两性氧化物,所以它能溶解于盐酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com