
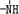 、
、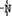 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-. 分析 氮原子最外层5个电子,每个氮原子和三个氮原子分别形成一个共用电子对,所以每个氮原子的最外层都达到8电子稳定结构,即N4为正四面体;
N4中氮原子均有1对孤对电子,与足量的H+反应生成的粒子的化学式为N4H44+,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,另外的离子为N3-.
解答 解:氮原子最外层5个电子,每个氮原子和三个氮原子分别形成一个共用电子对,所以每个氮原子的最外层都达到8电子稳定结构,即N4为正四面体,则1molN4中含有6mol对共用电子对;
N4中氮原子均有1对孤对电子,与足量的H+反应生成的粒子的化学式为N4H44+,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,另外的离子为N3-,则该物质熔融时的电离方程式为:N4H4=NH4++N3-,
故答案为:6mol;N4H44+;N4H4=NH4++N3-.
点评 本题考查较为综合,涉及物质的结构、微粒性质、电离方程式等问题,注意物质性质的迁移,题目难度中等,注意基础知识的把握.


科目:高中化学 来源: 题型:选择题
| A. | OH-+CO32-+2H+→HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+2H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| D. | 检验卤代烃中的卤原子:取足量液体与NaOH溶液共热后,再滴加AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
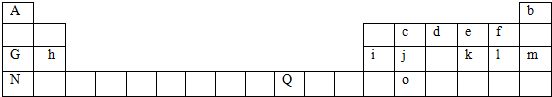
 ,其气态氢化物溶于水显碱性.(填“酸”或“碱”)
,其气态氢化物溶于水显碱性.(填“酸”或“碱”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )| A. | T℃时,该反应的平衡常数值为4 | |
| B. | c点没有达到平衡,此时反应向逆向进行 | |
| C. | 若c点为平衡点,则此时容器内的温度高于T℃ | |
| D. | T℃时,在d点加入一定量X可达到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、玻璃和水泥都是无机非金属材料;青铜、碳素钢和石英都是合金 | |
| B. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 | |
| C. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| D. | 食盐可作调味剂,也可作食品防腐剂;福尔马林可作食品的保鲜剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com