
| A. | CO2 | B. | KOH | C. | MgCl2 | D. | Na2O |
科目:高中化学 来源: 题型:解答题
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 8.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3+ClO-→2 H++SO42-+Cl- | B. | SO2+ClO-+H2O→2 H++SO42-+Cl- | ||
| C. | SO2+ClO-+H2O→SO32-+HClO | D. | SO2+ClO-+2OH-→SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol浓盐酸与足量MnO2 反应,可以得到0.5mol氯气 | |
| B. | 区别氯化钠溶液和氯化钾溶液,目前我们做不到 | |
| C. | 影响气体体积的主要因素是:分子大小、分子间距、分子数目 | |
| D. | 漂白粉露置空气中变质,既发生氧化反应又发生非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O4和O2互为同位素 | |
| B. | O4转化O2为物理变化 | |
| C. | 18O是氧元素的一种核素,它的中子数是8 | |
| D. | 同温同压下,等体积的O4气体和O2含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 肯定有Al3+、Mg2+、Cl-,可能有K+ | |
| B. | 肯定有Al3+、Mg2+,可能有CO32- | |
| C. | 肯定有Al3+、Mg2+、Cl-,肯定没有NH4+ | |
| D. | 肯定有Al3+、Cl-,可能有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
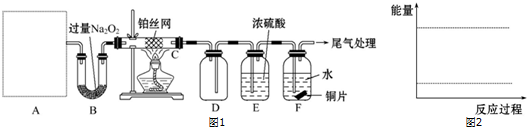
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com