
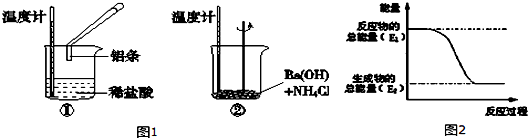
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)自发进行的放热的氧化还原反应能设计成原电池;该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应.
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应;
反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;
故答案为:放;吸;①;
(2)自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;
故答案为:B;Cu;FeCl3溶液;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+.
点评 本题考查根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{a}$(N-a) mol | B. | $\frac{a}{A+n}$(n+A)mol | C. | $\frac{A}{a+n}$(N+n) mol | D. | $\frac{a}{A+n}$(A-N+n) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 -CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH
-CH2CH3$\stackrel{酸性KMn_{4}O_{2}溶液}{→}$C6H5-COOH +HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O
+HNO3 $→_{55~60℃}^{浓硫酸}$C6H5NO2 +H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
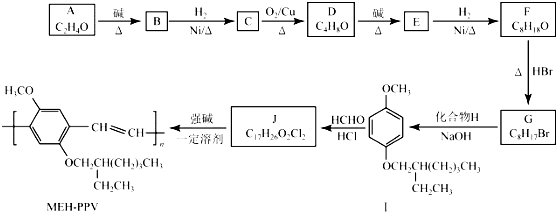
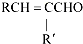 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)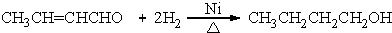 .
.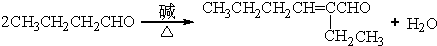 .
.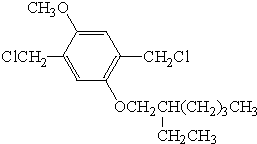 .
.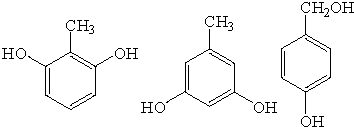 .
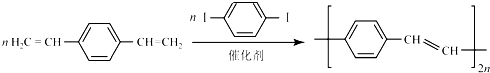
.
 、
、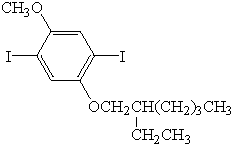 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
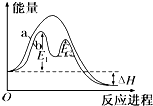
| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com