
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硝基苯的结构简式: | |
| C. | (CH3 CH2)2 CHCH2CH3 的名称:2-乙基丁烷 | |
| D. | 甲基的电子式为: |
分析 A.乙烯分子中含有碳碳双键,其结构简式中没有标出官能团结构;
B.硝基中N原子与苯环的C相连;
C.烷烃的命名中出现2-乙基,说明选取的主链错误;
D.甲基为中性原子团,碳原子最外层含有7个电子.
解答 解:A.乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故A错误;
B.硝基苯中,硝基的N原子与苯环相连,硝基苯正确的结构简式为: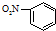 ,故B错误;
,故B错误;
C.(CH3 CH2)2CHCH2CH3 的最长碳链含有5个C,主链为戊烷,其正确名称为:3-乙基戊烷,故C错误;
D.甲基中含有3个C-H键,碳原子最外层含有7个电子,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、有机物命名等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | He | B. | S | C. | Si | D. | P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100 nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴,溴元素又称“海洋元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | C8H16 | C. | C8H8 | D. | C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com