
在氯化铵溶液中,下列关系式正确的是( )
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. c(NH4+)> c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D. c(NH4+)= c(Cl-)>c(H+)>c(OH-)
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:简答题
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
下列物质的名称或俗名与化学式相对应的
A. 小苏打——Na2CO3 B. 火碱——Na2O2
C. 磁性氧化铁——Fe2O3 D. 醋酸——CH3COOH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:实验题
某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol·L-1,滴定前将白醋稀释 (填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:选择题
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO32-+6H2O.则下列说法正确的是
A. 电池放电时通入空气的电极为负极
B. 由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大
C. 电池放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O
D. 电池放电时每消耗1 mol CH3OH转移8 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省湛江市高二上学期期末调研考试化学试卷(解析版) 题型:选择题
下列各组离子能大量共存且溶液颜色为无色的是
A. Na+、MnO4-、K+、NO3-、SO32- B. Na+、S2-、SO32-、H+、、NO3-
C. Na+、S2-、OH-、K+、Cl- D. HCO3-、H+、Na+、Ca2+、SO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:简答题
(1)NaBH4与水反应生成NaBO2和氢气,在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4放热21.6 kJ,该反应的热化学方程式是________________。
(2)相同温度下,等物质的量浓度的下列溶液:①(NH4)2SO4 ②(NH4)2CO3 ③(NH4)2Fe(SO4)2 ④NH4HSO4 ⑤NH4Cl ⑥NH3·H2O, c(NH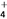 )大小顺序为________________。
)大小顺序为________________。
(3)在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤某种气体的百分含量
a.能说明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是________。
2SO3(g)达到平衡状态的是________。
b.能说明A(s)+2B(g) C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
H2S(g)+ O2(g)===SO2(g)+H2O(g)ΔH1
O2(g)===SO2(g)+H2O(g)ΔH1
2H2S(g)+SO2(g)=== S2(g)+2H2O(g)ΔH2
S2(g)+2H2O(g)ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g)ΔH3 2S(g)===S2(g)ΔH4
O2(g)===S(g)+H2O(g)ΔH3 2S(g)===S2(g)ΔH4
则ΔH4的正确表达式为
A. ΔH4= (ΔH1+ΔH2-3ΔH3) B. ΔH4=
(ΔH1+ΔH2-3ΔH3) B. ΔH4= (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4= (ΔH1+ΔH2-3ΔH3) D. ΔH4=
(ΔH1+ΔH2-3ΔH3) D. ΔH4= (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省张家口市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子检验的方法正确的是
A. 向某无色溶液中加入BaCl2溶液,产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42-
B. 向某无色溶液中加入盐酸,有无色、无味的气体产生,则说明原溶液中一定有CO32-
C. 灼烧某白色粉末,火焰呈黄色,则说明原粉末中有Na+,无K+
D. 向某溶液中滴加硫氰化钾溶液,溶液不变红,再滴加氯水,溶液变红,说明原溶液一定有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com